
【题目】下列氧化还原反应方程式,所标电子转移方向与数目错误的是( )

A. A B. B C. C D. D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)

(1)操作②为什么不用硝酸钡溶液,其理由是_______________________________;
(2)进行操作②后,如何判断SO42-已除尽,方法是___________________________;
(3)操作③的目的是____________,其中涉及到的离子方程式是_______________;
(4)往滤液中加入盐酸的离子方程式是__________________________________;
(5)NH4HCO3在水溶液中的电离方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________、_______。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:

甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、有机合成等行业。CuCl晶体呈白色,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解氧化为绿色的[Cu 2(OH)3C1],见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl,设计的合成路线如下:

己知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮。
②CuCl在溶液中存在:CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)。
[CuCl3]2-(aq)。
请回答:
(1)下列叙述正确的是__________。
A.CuCl2原料中含有的Fe2+等杂质经氧化、萃取几乎都在有机相中被除去
B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇![]()
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.用浓盐酸洗涤分液后的有机相时,需在分液漏斗中进行
(2)上述合成路线中,SO2通入混合液的实验装置如下图所示:

①装置D的作用是_______________。
②C中反应的离子方程式为_____________。
(3)上述合成路线中,向混合液中加入大量去氧水的目的是________________。
(4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。干燥时应注意密封、____________。
(5)现称取l.200g产品,用硫酸酸化的硫酸铁溶解,并稀释成250mL。每次用移液管移取25.00mL溶液于锥形瓶中,用0.01000,mol·L-1KmnO4溶液滴定平均消耗24.00mL。
①用移液管吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为____________。
②产品中CuCl的纯度为__________(本实验条件下,Cl-难于被MnO4-氧化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g) +O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99KJ/mol。请回答下列问题:
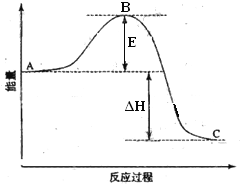
①图中A、C分别表示________、_______;
②E表示________;E的大小对该反应的反应热____(填“有”或“无”)影响。
③该反应通常用V2O5作催化剂,加V2O5会使图△H______(填“变大”、“变小”或“不变”),图中△H =______KJ/mol;
④已知单质硫的燃烧热为296 KJ/mol,计算由S(s)生成3molSO3(g)的△H=________KJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两串联电解池,左边放硫酸铜,右边放一定量的某硝酸盐溶液,电解时当左池有1.6g Cu析出时,右池析出0.45g固体,则右池溶质为:
A.AgNO3 B.NaNO3 C.Mg(NO3)2 D.Al(NO3)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如右图所示。下列说法不正确的是

A. 该反应的化学方程式为5A+4B![]() 4C
4C
B. 2min前,正反应速率逐渐减小,逆反应速率逐渐增大
C. 用B的浓度变化表示2min内的速率为2mol/(L·min)
D. 2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com