
按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是
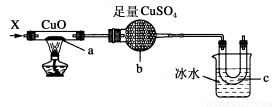
A.H2 B.CO和H2 C.NH3 D.CH3CH2OH(气)
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源:2015-2016学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。下列说法正确的是
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式 | 电离常数(298 K) |
硼酸 | K=5.7×10-10 |
碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
醋酸 | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.中和100 mL 1 mol/L的H2SO4溶液,需NaOH 4 g
D.配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期第一次月考化学试卷(解析版) 题型:实验题
“8.12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)NaCN溶液呈碱性的原因是 (用离子方程式表示)
(2)下列选项错误的是
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
(3)H2O2有有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-) c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验。将CN-的浓度为0.2000 mol/L的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
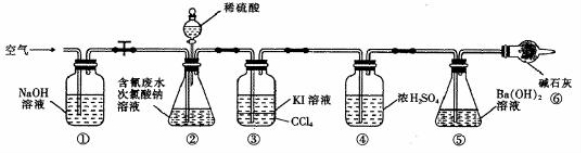
已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl-
2CNO-+2H+ + 3C1O-=N2↑+2CO2↑+ 3C1-+H2O
(5)①和⑥的作用是 。
(6)反应结束后,缓缓通入空气的目的是 。
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置 反应前后的质量(从装置①到⑥中选择,填装置序号)。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期第一次月考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数。 下列说法正确的是
下列说法正确的是
A.7.8 g Na2O2中含有的阴离子数目为0.2NA
B.足量Zn与一定量的浓硫酸反应,产生22.4L(标准状况)气体时转移的电子数一定为2NA
C.1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA
D.氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高二下期末化学试卷(解析版) 题型:填空题
(1~4小题每空2分,5~6小题每空3分,共14分)A~G是几种烃的分子球棍模型(如图),据此回答下列问题:

(1)常温下含碳量最 高的气态烃是________(填字母)。
高的气态烃是________(填字母)。
(2)不能够发生 加成的烃有________种。
加成的烃有________种。
(3)一卤代物有两种的是________(填字母)。
(4)等质量的上述烃燃烧耗氧最多的是 (填字母)。
(5)写出实验室制C的化学方程式_______________。
(6)写出F发生溴代反应的化学方程式________ ____。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二9月月考化学试卷(解析版) 题型:选择题
已知:101 kPa时1 mol 辛烷燃烧生成液态水时放出热量为5 518 kJ;强酸和强碱在稀溶液中发生反应生成1 mol H2O时放出的热量为57.3 kJ,下列热化学方程式书写正确的是
①2C8H18(l)+25O2(g) =16CO2(g)+18H2O(g) ΔH=-11 036 kJ/mol
②2C8H18(l)+25O2(g) =16CO2(g)+18H2O(l) ΔH=-11 036 kJ/mol
③H++OH-=H2O ΔH=-57.3 kJ/mol
④2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol
A.①③ B.②③
C.②④ D.只有②
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三第二次月考化学试卷(解析版) 题型:填空题
(13分)铁的发现和大规模使用,是人类发展史上的一个光辉里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3 + 3NaClO + 4NaOH = 2Na2FeO4 + 3X + 5H2O,则X的化学式 ,反应中被氧化的物质是 (写化学式)。
(2)铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
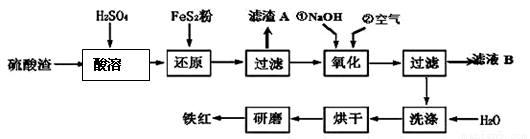
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 __ ;“滤渣A”主要成份的化学式为 。
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
FeS2 + Fe3 + + H2O == Fe2 + + SO42- + ___ 。
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
如果pH过大,可能引起的后果是_________;滤液B可以回收的物质有________(写化学式)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第一次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L水含有NA个H2O分子
B.1 mol/L 溶液中含有
溶液中含有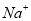 数目为
数目为
C.常温常压下,22.4L O2中含有 个氧原子
个氧原子
D.16g O2 和O3的混合气体中含氧原子数目为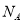
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com