
【题目】下列有关叙述正确的是( )
A. 在![]() 分子中含有1个手性C原子
分子中含有1个手性C原子
B. 氢键是一种特殊化学键,它广泛地存在于自然界中
C. 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D. 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
科目:高中化学 来源: 题型:
【题目】已知:D为烃;E分子中碳元素与氢元素的质量之比6∶1,相对分子质量为44,其燃烧产物只有CO2和H2O。A的最简式与F相同,且能发生银镜反应,可由淀粉水解得到。

(1)A的结构简式为__________________。
(2)写出D→E的化学方程式:_______________________。
(3)下列说法正确的是____。
A.有机物F能使石蕊溶液变红
B.用新制的氢氧化铜无法区分有机物C、E、F的水溶液
C.等物质的量的C和D分别完全燃烧消耗氧气的量相等
D.可用饱和碳酸钠溶液除去有机物B中混有的少量C、F
E. B的同分异构体中能发生银镜反应的酯类共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.乙酸与乙醇的酯化反应:CH3COOH+C2H518OH![]() CH3COOC2H5+H218O
CH3COOC2H5+H218O
B.工业上冶炼铝:2AlCl3(熔融)![]() 2Al+3Cl2↑
2Al+3Cl2↑
C.甲烷与氯气产生一氯甲烷:CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
D.足量SO2通入澄清石灰水:SO2+Ca2++2OH-=CaSO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是__________________________________。
(3)A、B、C 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。

(5)A的最简单氢化物分子的空间构型为________,其中A原子的杂化类型是________。
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用ρ、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】该表是元素周期表中的一部分:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
4 |
回答下列问题:
(1)⑦是____________,原子半径最大的是____________。(填元素符号或化学式,下同)
(2)⑧⑨四种元素形成的简单离子,半径由大到小的顺序是________。
(3)上述元素中,最高价氧化物的水化物中,酸性最强的化合物的分子式是____________,碱性最强的化合物的电子式____________。
(5)①和氢元素形成的化合物很多,其中C2H6可用于形成燃料电池,若用NaOH作电解质溶液,写出该燃料电池的负极反应方程式____________。
(6)CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如表:
2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如表:
化学键 | C-H | C=O | H-H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应产生2molH2(g)时____________(填“放出”或“吸收”)热量为____________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池式氧传感器原理构造如图,可测定O2的含量。工作时铅极表面会逐渐附着Pb(OH)2。下列说法不正确的是
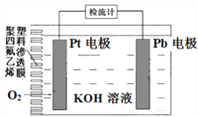
A. Pt电极上发生还原反应
B. 随着使用,电解液的pH逐渐减小
C. a ×10-3molO2反应,理论上可使Pb电极增重68a mg
D. Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种常见元素结构信息如下表,试根据信息回答有关问题:
元素 | A | B | C |
结构信息 | 基态原子核外有两个电子层,最外层有3个未成对电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 |
(1)写出B原子的基态电子排布式__;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键__(任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角__(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__,简要描述该配合物中化学键的成键情况__;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“”表示没有形成共价键的最外层电子,短线表示共价键.

在以上分子中,中心原子采用sp3杂化形成化学键是__(填写序号);在②的分子中有__个σ键和__个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为CH3CH2OH![]() CH2=CH2↑+H2O,回答下列问题:
CH2=CH2↑+H2O,回答下列问题:

(1)图1中仪器①、②的名称分别为______、______。
(2)收集乙烯气体最好的方法是______。
(3)向溴的四氯化碳溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于_____(填反应类型),若将反应后无色液体中的反应产物分离出来,则宜采用的方法是_____。
II.为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性的气体杂质,由此他提出必须先除去杂质,然后再使乙烯与溴水反应。
请回答下列问题:
(4)甲同学的实验中有关的化学方程式为______。
(5)甲同学设计的实验______(填“能”或“不能”)验证乙烯与溴发生加成反应,其理由是_____(填字母)。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质就是乙烯
(6)乙同学推测此乙烯中必定含有的一种杂质气体是______,它与溴水反应的化学方程式是___。在验证过程中必须全部除去,除去该杂质的试剂可选用______。
(7)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取方法有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是化学常用来定量测定物质浓度的一种重要的实验方法。在食品工业、药品制造、化妆品行业等等都被广泛应用。
(I)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是________,水通入A的进口为________。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。
(2)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为________。滴定终点现象为_______________。
(3)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是_________________,在不改变装置的情况下,如何改进:______________________________________________。
(II)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO)。饮用水中的ClO2、ClO含量可用连续碘量法进行测定。ClO2被I-还原为ClO、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO也能被I-完全还原为Cl-。反应生成的I-用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI。

(1)请写出pH≤2.0时ClO与I-反应的离子方程式:_________________________。
(2)请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中;
步骤2:调节水样的pH为7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL;
步骤5:______________;
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,又消耗Na2S2O3溶液V2 mL。
(3)根据上述分析数据,测得该饮用水中ClO的浓度为________ mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com