
【题目】滴定法是化学常用来定量测定物质浓度的一种重要的实验方法。在食品工业、药品制造、化妆品行业等等都被广泛应用。
(I)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是________,水通入A的进口为________。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。
(2)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为________。滴定终点现象为_______________。
(3)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是_________________,在不改变装置的情况下,如何改进:______________________________________________。
(II)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO)。饮用水中的ClO2、ClO含量可用连续碘量法进行测定。ClO2被I-还原为ClO、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO也能被I-完全还原为Cl-。反应生成的I-用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI。

(1)请写出pH≤2.0时ClO与I-反应的离子方程式:_________________________。
(2)请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中;
步骤2:调节水样的pH为7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL;
步骤5:______________;
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,又消耗Na2S2O3溶液V2 mL。
(3)根据上述分析数据,测得该饮用水中ClO的浓度为________ mol·L-1(用含字母的代数式表示)。
【答案】 冷凝管 b 酚酞 当滴入最后一滴烧碱溶液时,溶液变红且半分钟不褪色 0.24 盐酸的挥发 用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响 ClO![]() +4H++4I-=Cl-+2I2+2H2O 调节溶液的pH≤2.0
+4H++4I-=Cl-+2I2+2H2O 调节溶液的pH≤2.0 ![]()
【解析】本题主要考查滴定法的应用。
(I)(1)仪器A的名称是冷凝管,水的流向是“下进上出”,水通入A的进口为b。
(2)若滴定终点时溶液的pH=8.8,溶液呈碱性,则选择的指示剂为酚酞。滴定终点现象为当滴入最后一滴烧碱溶液时,溶液变红且半分钟不褪色。
(3) SO2~H2SO4~2NaOH,该葡萄酒中SO2含量为:0.0900mol·L-1×25.00 mL/2×64g/mol/300mL=0.24g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是盐酸的挥发,在不改变装置的情况下,如何改进:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响。
(II)(1)pH≤2.0时ClO被I-还原为Cl-,ClO与I-反应的离子方程式:ClO![]() +4H++4I-=Cl-+2I2+2H2O。
+4H++4I-=Cl-+2I2+2H2O。
(2)步骤5:调节溶液的pH≤2.0;
(3) ClO2~I-~Na2S2O3,ClO~I-~4Na2S2O3,该饮用水中ClO的物质的量为(cV2/4-cV1)mol,浓度为![]() mol·L-1。
mol·L-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素(H2NCONH2)直接转化为对环境友好物质的原电池装置。现利用甲装置产生的电能对乙装置中的饱和食盐水进行电解(A、B皆为石墨电极)。下列说法中不正确的是( )

①M电极反应式:H2NCONH2+H2O+6e-=CO2↑+N2↑+6H+
②当A电极产生11.2mL气体(标况)时,则N电极消耗25×10-4mol气体
③甲中H+透过质子交换膜由右向左移动
④A电极应与X相连接
⑤反应一段时间后,乙装置U型管中的溶液pH变大
A. ①③ B. ①③⑤ C. ①②③ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O,摩尔质量为183g/mol),受热过程中不同温度范国内分别得到一种固体物质,其质量如下表:
温度范围℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,210℃~290℃过程中产生的气体只有CO2,则290℃~320℃温度范围内的固体物质是
A. CoO B. Co2O3 C. Co3O4 D. Co4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系:
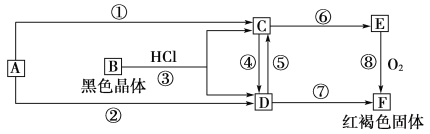
(1)确定A、B、C、D、E、F的化学式,A为________,B为________,C为________,D为________,E为________,F为________。
(2)写出①⑧的化学方程式,④、⑤的离子方程式。
①_________________________________________________,
⑧_________________________________________________,
④________________________________________________,
⑤___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=6.0×10-4,Ksp(MgF2)=5.0×10-11。现向1 L 0.2 mol·L-1 HF溶液中加入 1 L 0.2 mol·L-1 MgCl2溶液。下列说法中正确的是( )
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. 0.2 mol·L-1 MgCl2溶液中离子浓度关系为2c(Mg2+)=c(Cl-)>c(H+)=c(OH-)
C. 2HF(aq)+Mg2+(aq)![]() MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
D. 该反应体系中有MgF2沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机化学中,硫酰氯(SO2Cl2)长用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。
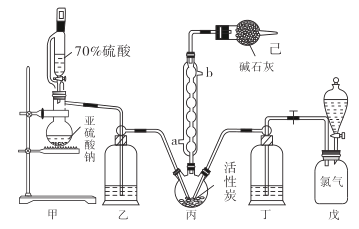
已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置丙中作为反应容器的仪器的名称为_______,装置丙中球形冷凝管的作用是________;如何控制两种反应物体积相等:____________________________________。
(2)装置戊上方分液漏斗中最好选用下列试剂:_________________(选填字母)
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 molL-1盐酸
(3)若缺少装置己,硫酰氯(SO2Cl2)会和空气中的水反应而变质,其化学方程式是______________________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H![]() SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是_________________________________(用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为___________。
(7)请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:D为烃;E分子中碳元素与氢元素的质量之比6∶1,相对分子质量为44,其燃烧产物只有CO2和H2O。A的最简式与F相同,且能发生银镜反应,可由淀粉水解得到。

(1)A的结构简式为__________________。
(2)写出D→E的化学方程式:_______________________。
(3)下列说法正确的是____。
A.有机物F能使石蕊溶液变红
B.用新制的氢氧化铜无法区分有机物C、E、F的水溶液
C.等物质的量的C和D分别完全燃烧消耗氧气的量相等
D.可用饱和碳酸钠溶液除去有机物B中混有的少量C、F
E. B的同分异构体中能发生银镜反应的酯类共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
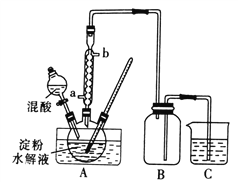
实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%HSO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为________;步骤②中,水浴加热的优点为__________。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
___C6H12O6+___HNO3 ![]() ___H2C2O4+9NO2↑+3NO↑+ ______
___H2C2O4+9NO2↑+3NO↑+ ______
(3)称取mg草酸晶体粗产品,配成100mL溶液。取20.00mL于锥形瓶中,用amoL·L-1KMnO4标准液标定,只发生
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为___________。
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择下述装置验证产物CO2,装置B的主要作用是__________。
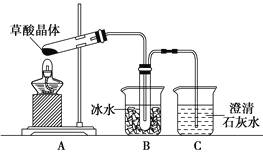
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
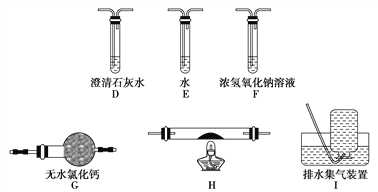
①乙同学的实验装置中,依次连接的合理顺序为A、B、_____________。其中装置H反应管中盛有的物质是________________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com