
【题目】如图甲是一种利用微生物将废水中的尿素(H2NCONH2)直接转化为对环境友好物质的原电池装置。现利用甲装置产生的电能对乙装置中的饱和食盐水进行电解(A、B皆为石墨电极)。下列说法中不正确的是( )

①M电极反应式:H2NCONH2+H2O+6e-=CO2↑+N2↑+6H+
②当A电极产生11.2mL气体(标况)时,则N电极消耗25×10-4mol气体
③甲中H+透过质子交换膜由右向左移动
④A电极应与X相连接
⑤反应一段时间后,乙装置U型管中的溶液pH变大
A. ①③ B. ①③⑤ C. ①②③ D. ②④⑤
【答案】A
【解析】该装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应。①H2NCONH2在负极M上失电子发生氧化反应,生成氮气、二氧化碳和水,电极反应式为H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+,故①错误;②根据图示,A极产生的氢气密度比空气小,为氢气,则A为阴极,当A电极产生11.2mL气体(标况)时,物质的量为![]() =0.0005mol,转移电子0.001mol,则N电极消耗氧气的物质的量=
=0.0005mol,转移电子0.001mol,则N电极消耗氧气的物质的量=![]() =25×10-4mol,故②正确;③M是负极,N是正极,H+透过离子交换膜由左M极移向右N极,故③错误;④A电极为阴极,与原电池的负极相连,即与X相连接,故④正确;⑤反应一段时间后,乙装置中反应生成氢氧化钠,溶液pH变大,故⑤正确;不正确的有①③,故选A。
=25×10-4mol,故②正确;③M是负极,N是正极,H+透过离子交换膜由左M极移向右N极,故③错误;④A电极为阴极,与原电池的负极相连,即与X相连接,故④正确;⑤反应一段时间后,乙装置中反应生成氢氧化钠,溶液pH变大,故⑤正确;不正确的有①③,故选A。


科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:

(1)配平反应的化学方程式为:___Zn + ___H2SO4(浓) = ___ZnSO4 ___SO2 ↑+ ___H2O。
(2)丙同学在安装好装置后,必不可少的一步操作是_________________________。
(3)A中加入的试剂可能是___________溶液;
B中加入的试剂可能是____________;
C中发现黑色固体变成红色,加入的试剂可能是____________。
D中加入的试剂可能是____________。
E中加入的试剂可能是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素形成的酸有硝酸、亚硝酸(HNO2)等,其中HNO2为一元弱酸。
(1)写出HNO2溶液与NaOH溶液反应的离子方程式:___________________。
(2)亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应:2NaNO2 + 4HI ═ 2NO↑ + 2NaI + I2 + 2H2O
①用双线桥标出该反应的电子转移方向及个数。______
②该反应被氧化的元素是_____,其中被氧化的元素占该元素总量的______(填百分数)。
(3)硝酸盐可作为烟幕弹。如反应:NH4NO3+Zn=ZnO+N2↑+2H2O,反应中NH4NO3作为_____(填选项)
A.氧化剂 B.还原剂 C.既做氧化剂又做还原剂
(4)实验室需配制0.1molL﹣1的NH4NO3溶液500mL。
①配制时,应用托盘天平称取NH4NO3的质量为_________。
②配制中已有托盘天平(带砝码和镊子)、烧杯、药匙、玻璃棒,还需要的玻璃仪器有_________。
③定容时俯视刻度线,所配得溶液的浓度_____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是

A. V=20mL
B. 在点①所示溶液中:c(Cl-)=c(H+)
C. 在点②所示溶液中:c(H+)=c(NH3·H2O)+c(OH-)
D. 在点②、③之间可能存在:c(NH4+)>c(Cl-)=c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:
(1)磷酸是三元中强酸,将磷酸加强热时可发生分子间的脱水生成焦磷酸(H4P2O7)、三聚磷酸(H5P3O10)以至直链多聚磷酸.当直链多聚磷酸分子中P原子数为20时,其化学式是_________.直链多聚磷酸常用于制取阻燃剂
(2)PH3是一种性能良好的熏蒸剂,用于除治储藏物害虫.
①与同主族元素的氢化物NH3相比,沸点:PH3 ___NH3(填“<”或“>”或“=”);稳定性:PH3 __NH3(填“<”、“>”或“=”); 实验室制取PH3可选用PH4I与______(填物质类别)反应得到.
②PH3气体发生器中常用磷化铝水解,其化学反应方程式是_____________.
(3)利用葡萄糖与银氨溶液反应在热水瓶胆内壁镀银.查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)Ag(NH3)2+(aq),该反应平衡常数K稳[Ag(NH3)2+]=1.10×107,又已知Ksp[AgCl]=1.45×10﹣20.计算可逆反应AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl﹣(aq)的化学平衡常数K=________(保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl____mol(保留2位有效数字).
(4)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
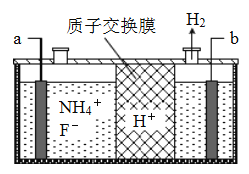
a电极为电解池的___(填“阴”或“阳”)极,其电极反应式为____________________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化学物质,在生产和生活中有广泛的用途。
(1)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用氯酸钾和浓盐酸反应制备氯气的化学方程式可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,其中该反应的氧化剂为_____________(填化学式,下同),还原剂为_________________,若反应产生0.3mol Cl2,则消耗的还原剂的物质的量为________mol,反应转移的电子数是_______________。
(2)已知:在加热条件下,3NaClO![]() 2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是化学常用来定量测定物质浓度的一种重要的实验方法。在食品工业、药品制造、化妆品行业等等都被广泛应用。
(I)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是________,水通入A的进口为________。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。
(2)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为________。滴定终点现象为_______________。
(3)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是_________________,在不改变装置的情况下,如何改进:______________________________________________。
(II)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO)。饮用水中的ClO2、ClO含量可用连续碘量法进行测定。ClO2被I-还原为ClO、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO也能被I-完全还原为Cl-。反应生成的I-用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI。

(1)请写出pH≤2.0时ClO与I-反应的离子方程式:_________________________。
(2)请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中;
步骤2:调节水样的pH为7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL;
步骤5:______________;
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,又消耗Na2S2O3溶液V2 mL。
(3)根据上述分析数据,测得该饮用水中ClO的浓度为________ mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com