
【题目】氯气是一种重要的化学物质,在生产和生活中有广泛的用途。
(1)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用氯酸钾和浓盐酸反应制备氯气的化学方程式可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,其中该反应的氧化剂为_____________(填化学式,下同),还原剂为_________________,若反应产生0.3mol Cl2,则消耗的还原剂的物质的量为________mol,反应转移的电子数是_______________。
(2)已知:在加热条件下,3NaClO![]() 2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
【答案】KClO3 HCl 0.5 3.01×1023个(0.5 NA个) 3Cl2+6NaOH![]() NaClO3 +5NaCl+3H2O 5:9
NaClO3 +5NaCl+3H2O 5:9
【解析】
(1)根据反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O可以看出,该氧化还原反应中,若有3 mol氯气生成,则有1 mol KClO3中Cl元素化合价降低为0价,作氧化剂;6 mol HCl中有5 mol氯元素化合价升高为0价,1 mol HCl起酸性作用生成KCl,即作还原剂的浓盐酸为5 mol,再结合氯气和转移电子之间的关系式、原子守恒计算还原剂的物质的量与实际转移电子数;
(2)加热下,氯气和浓氢氧化钠溶液反应生成氯化钠、氯酸钠和水;Cl2生成ClO-与ClO3-是被氧化的过程,Cl2生成NaCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO-与ClO3-的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被还原的氯元素和被氧化的氯元素的物质的量之比。
根据反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O可以看出,该氧化还原反应中,若有3 mol Cl2生成,则有1 mol KClO3中Cl元素化合价降低为0价,6 mol HCl中有5 mol氯元素化合价升高为0价,1 mol HCl起酸性作用生成KCl,即作还原剂的浓盐酸为5 mol。化合价降低值=化合价升高值=转移电子数=5 mol。则产生0.3 mol Cl2,则消耗的还原剂的物质的量是0.5 mol,转移电子的物质的量也为0.5 mol,所以转移电子数为0.5 mol![]() 6.02
6.02![]() 1023mol-1 = 3.01×1023个(0.5 NA),
1023mol-1 = 3.01×1023个(0.5 NA),
故答案为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;0.5 mol;3.01×1023个(0.5 NA个);
(2)常温下,Cl2可与NaOH溶液反应生成NaCl、NaClO和水,其化学方程式为:Cl2+NaOH=NaCl+NaClO+H2O,根据题意可知,在加热条件下,3NaClO![]() 2NaCl+NaClO3,结合上述两式可得,则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为3Cl2+6NaOH
2NaCl+NaClO3,结合上述两式可得,则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为3Cl2+6NaOH![]() NaClO3 +5NaCl+3H2O;
NaClO3 +5NaCl+3H2O;
Cl2生成ClO与ClO3是被氧化的过程,化合价分别由0价升高为+1价和+5价,ClO与ClO3的物质的量浓度之比为4:1,则可设ClO为4 mol,ClO3为1 mol,被氧化的Cl共为5 mol,失去电子的总物质的量为4mol×(10)+1mol×(50) = 9mol,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,Cl2生成NaCl是被还原的过程,化合价由0价降低为1价,则得到电子的物质的量也应为9 mol,则被还原的Cl的物质的量为9 mol,所以被氧化的氯元素的物质的量和被还原的氯元素之比为5 mol:9 mol =5:9,
故答案为:3Cl2+6NaOH![]() NaClO3 +5NaCl+3H2O;5:9。
NaClO3 +5NaCl+3H2O;5:9。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有关如下所示化合物的说法不正确的是( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素(H2NCONH2)直接转化为对环境友好物质的原电池装置。现利用甲装置产生的电能对乙装置中的饱和食盐水进行电解(A、B皆为石墨电极)。下列说法中不正确的是( )

①M电极反应式:H2NCONH2+H2O+6e-=CO2↑+N2↑+6H+
②当A电极产生11.2mL气体(标况)时,则N电极消耗25×10-4mol气体
③甲中H+透过质子交换膜由右向左移动
④A电极应与X相连接
⑤反应一段时间后,乙装置U型管中的溶液pH变大
A. ①③ B. ①③⑤ C. ①②③ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
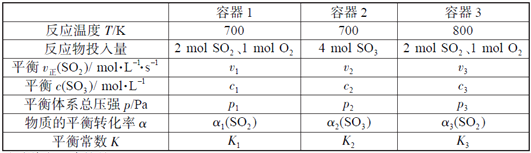
下列说法正确的是
A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3
C. v1< v3,α1(SO2 ) >α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为
(2x)Al2(SO4)3+3xCaCO3+3xH2O![]() 2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
(1)制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有___________________。
(2)碱式硫酸铝溶液吸收SO2过程中,溶液的pH___________(填“增大”、“减小”、“不变”)。
(3)通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
A | B | C | D |
|
|
|
|
实验室制取蒸馏水 | 用SO2和NaOH溶液做喷泉实验 | 证明Na2CO3的热稳定性比NaHCO3好 | 证明铜与浓硝酸的反应是放热反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O,摩尔质量为183g/mol),受热过程中不同温度范国内分别得到一种固体物质,其质量如下表:
温度范围℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,210℃~290℃过程中产生的气体只有CO2,则290℃~320℃温度范围内的固体物质是
A. CoO B. Co2O3 C. Co3O4 D. Co4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系:
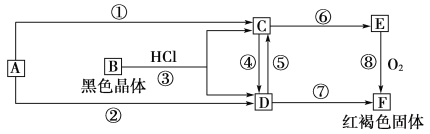
(1)确定A、B、C、D、E、F的化学式,A为________,B为________,C为________,D为________,E为________,F为________。
(2)写出①⑧的化学方程式,④、⑤的离子方程式。
①_________________________________________________,
⑧_________________________________________________,
④________________________________________________,
⑤___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:D为烃;E分子中碳元素与氢元素的质量之比6∶1,相对分子质量为44,其燃烧产物只有CO2和H2O。A的最简式与F相同,且能发生银镜反应,可由淀粉水解得到。

(1)A的结构简式为__________________。
(2)写出D→E的化学方程式:_______________________。
(3)下列说法正确的是____。
A.有机物F能使石蕊溶液变红
B.用新制的氢氧化铜无法区分有机物C、E、F的水溶液
C.等物质的量的C和D分别完全燃烧消耗氧气的量相等
D.可用饱和碳酸钠溶液除去有机物B中混有的少量C、F
E. B的同分异构体中能发生银镜反应的酯类共有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com