
【题目】(题文)(题文)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
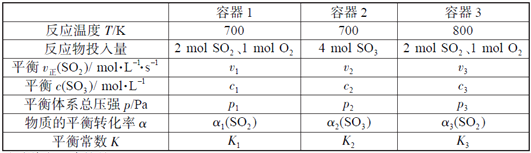
下列说法正确的是
A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3
C. v1< v3,α1(SO2 ) >α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
【答案】CD
【解析】分析:对比容器的特点,将容器1和容器2对比,将容器1和容器3对比。容器2中加入4molSO3等效于在相同条件下反应物投入量为4molSO2和2molO2,容器2中起始反应物物质的量为容器1的两倍,容器2相当于在容器1达平衡后增大压强,将容器的体积缩小为原来的一半,增大压强化学反应速率加快,υ2![]() υ1,增大压强平衡向正反应方向移动,平衡时c2
υ1,增大压强平衡向正反应方向移动,平衡时c2![]() 2c1,p2
2c1,p2![]() 2p1,α1(SO2)+α2(SO3)
2p1,α1(SO2)+α2(SO3)![]() 1,容器1和容器2温度相同,K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3
1,容器1和容器2温度相同,K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3![]() υ1,升高温度平衡向逆反应方向移动,平衡时c3
υ1,升高温度平衡向逆反应方向移动,平衡时c3![]() c1,p3
c1,p3![]() p1,α3(SO2)
p1,α3(SO2)![]() α1(SO2),K3
α1(SO2),K3![]() K1。
K1。
详解:对比容器的特点,将容器1和容器2对比,将容器1和容器3对比。容器2中加入4molSO3等效于在相同条件下反应物投入量为4molSO2和2molO2,容器2中起始反应物物质的量为容器1的两倍,容器2相当于在容器1达平衡后增大压强,将容器的体积缩小为原来的一半,增大压强化学反应速率加快,υ2![]() υ1,增大压强平衡向正反应方向移动,平衡时c2
υ1,增大压强平衡向正反应方向移动,平衡时c2![]() 2c1,p2
2c1,p2![]() 2p1,α1(SO2)+α2(SO3)
2p1,α1(SO2)+α2(SO3)![]() 1,容器1和容器2温度相同,K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3
1,容器1和容器2温度相同,K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3![]() υ1,升高温度平衡向逆反应方向移动,平衡时c3
υ1,升高温度平衡向逆反应方向移动,平衡时c3![]() c1,p3
c1,p3![]() p1,α3(SO2)
p1,α3(SO2)![]() α1(SO2),K3
α1(SO2),K3![]() K1。根据上述分析,A项,υ2
K1。根据上述分析,A项,υ2![]() υ1,c2
υ1,c2![]() 2c1,A项错误;B项,K3
2c1,A项错误;B项,K3![]() K1,p2
K1,p2![]() 2p1,p3
2p1,p3![]() p1,则p2
p1,则p2![]() 2p3,B项错误;C项,υ3
2p3,B项错误;C项,υ3![]() υ1,α3(SO2)
υ1,α3(SO2)![]() α1(SO2),C项正确;D项,c2
α1(SO2),C项正确;D项,c2![]() 2c1,c3
2c1,c3![]() c1,则c2
c1,则c2![]() 2c3,α1(SO2)+α2(SO3)
2c3,α1(SO2)+α2(SO3)![]() 1,α3(SO2)
1,α3(SO2)![]() α1(SO2),则α2(SO3)+α3(SO2)
α1(SO2),则α2(SO3)+α3(SO2)![]() 1,D项正确;答案选CD。
1,D项正确;答案选CD。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,如图所示是某厂应用“侯氏制碱法”生产纯碱的工艺流程图,据图回答:
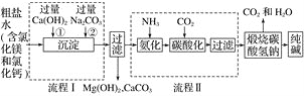
(1)上述流程图中,可循环利用的物质是____________。
(2)流程Ⅰ后过滤所得滤液中含有的溶质有__________。
(3)流程Ⅱ先通入氨气,再通入二氧化碳,如果反过来,二氧化碳的吸收率会降低,这是因为___________。
(4)用一个化学反应方程式表示出流程Ⅱ中发生的总反应____。
(5)工业生产纯碱的流程中,碳酸化时溶液中先析出碳酸氢钠而没有析出氯化铵的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:
(1)磷酸是三元中强酸,将磷酸加强热时可发生分子间的脱水生成焦磷酸(H4P2O7)、三聚磷酸(H5P3O10)以至直链多聚磷酸.当直链多聚磷酸分子中P原子数为20时,其化学式是_________.直链多聚磷酸常用于制取阻燃剂
(2)PH3是一种性能良好的熏蒸剂,用于除治储藏物害虫.
①与同主族元素的氢化物NH3相比,沸点:PH3 ___NH3(填“<”或“>”或“=”);稳定性:PH3 __NH3(填“<”、“>”或“=”); 实验室制取PH3可选用PH4I与______(填物质类别)反应得到.
②PH3气体发生器中常用磷化铝水解,其化学反应方程式是_____________.
(3)利用葡萄糖与银氨溶液反应在热水瓶胆内壁镀银.查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)Ag(NH3)2+(aq),该反应平衡常数K稳[Ag(NH3)2+]=1.10×107,又已知Ksp[AgCl]=1.45×10﹣20.计算可逆反应AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl﹣(aq)的化学平衡常数K=________(保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl____mol(保留2位有效数字).
(4)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
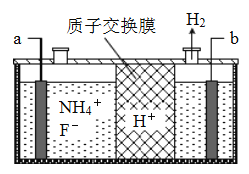
a电极为电解池的___(填“阴”或“阳”)极,其电极反应式为____________________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
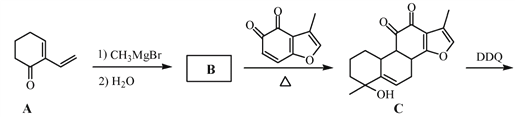
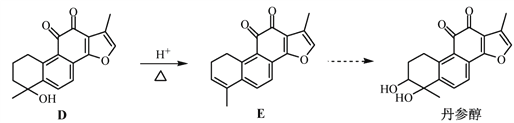
已知:![]()
(1)A中的官能团名称为__________________(写两种)。
(2)D![]() E的反应类型为__________________。
E的反应类型为__________________。
(3)B的分子式为C9H14O,写出B的结构简式:__________________。
(4)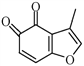 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)写出以![]() 和
和 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化学物质,在生产和生活中有广泛的用途。
(1)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用氯酸钾和浓盐酸反应制备氯气的化学方程式可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,其中该反应的氧化剂为_____________(填化学式,下同),还原剂为_________________,若反应产生0.3mol Cl2,则消耗的还原剂的物质的量为________mol,反应转移的电子数是_______________。
(2)已知:在加热条件下,3NaClO![]() 2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量盐酸,平衡逆向移动,c(OH-)增大
D.将水加热,Kw增大,pH不变,呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
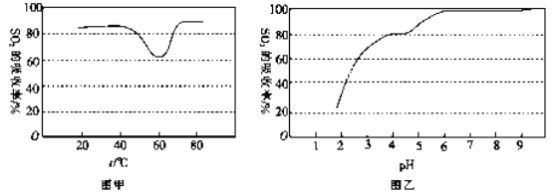
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
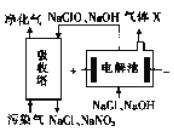
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com