
【题目】已知A为常见的金属单质,根据下图所示的关系:
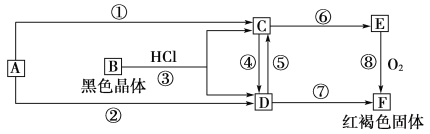
(1)确定A、B、C、D、E、F的化学式,A为________,B为________,C为________,D为________,E为________,F为________。
(2)写出①⑧的化学方程式,④、⑤的离子方程式。
①_________________________________________________,
⑧_________________________________________________,
④________________________________________________,
⑤___________________________________________________。
【答案】Fe Fe3O4 FeCl2 FeCl3 Fe(OH)2 Fe(OH)3 Fe+2HCl===FeCl2+H2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Fe2++Cl2===2Cl-+2Fe3+ Fe+2Fe3+===3Fe2+
【解析】
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,则A为铁。B为黑色晶体,为四氧化三铁,结合转化关系图解答。
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,已知A为常见的金属单质,则A为铁。B为黑色晶体,为四氧化三铁,B和盐酸反应生成氯化亚铁和氯化铁,根据转化关系分析,D为氯化铁,C为氯化亚铁,E为氢氧化亚铁。则
(1)根据以上分析可知A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3;
(2)反应①是铁和盐酸反应生成氯化亚铁和氢气,方程式为Fe+2HCl=FeCl2+H2↑;
反应⑧为氢氧化亚铁和氧气、水反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
反应④为亚铁离子被氯气氧化生成铁离子,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
反应⑤为铁离子变成亚铁离子,离子方程式为:2Fe3++Fe=3Fe2+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化学物质,在生产和生活中有广泛的用途。
(1)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用氯酸钾和浓盐酸反应制备氯气的化学方程式可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,其中该反应的氧化剂为_____________(填化学式,下同),还原剂为_________________,若反应产生0.3mol Cl2,则消耗的还原剂的物质的量为________mol,反应转移的电子数是_______________。
(2)已知:在加热条件下,3NaClO![]() 2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量盐酸,平衡逆向移动,c(OH-)增大
D.将水加热,Kw增大,pH不变,呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃的含氧衍生物X为主要原科生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A。合成线路如图:
}及阻燃剂四溴双酚A。合成线路如图:

已知:①X的蒸汽密度是相同条价下H2的47倍,遇FeCl3溶液显紫色;
②C为![]() ,
,![]()
③已知X→Y中,CH3COCH3断裂“C=O”键,Y有4种不同环境的H;
④
(1)原料X的分子式为_______;B的名称是_______;B--C的反应类型是_______;D的结构简式为_______ 。
(2)写出X→Y的化学方程式: ______________ 。
(3)1mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗___molNaOH.
(4)符合以下条件的D的同分异构体有__种(不考虑立体异构)。
①含有两个甲基和两种官能团②能使溴的CCl4溶液褪色③能同时发生水解和银镜反应
(5)已知由烯烃直接制备不饱和酯的新方法为![]() ,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图_______。
,写出合成该涂料的反应流程图_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A. 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH)=c(K+)>c(Ba2+)
B. 将10 mL 0.1 mol·L-1Na2CO3溶液逐滴滴加到10 mL 0.1 mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO)>c(CO![]() )
)
C. 向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH)+c(Na+)=c(HCO)+c(CO![]() )
)
D. 0.2 mol·L-1的某一元弱酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是化学常用来定量测定物质浓度的一种重要的实验方法。在食品工业、药品制造、化妆品行业等等都被广泛应用。
(I)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是________,水通入A的进口为________。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。
(2)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为________。滴定终点现象为_______________。
(3)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是_________________,在不改变装置的情况下,如何改进:______________________________________________。
(II)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO)。饮用水中的ClO2、ClO含量可用连续碘量法进行测定。ClO2被I-还原为ClO、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO也能被I-完全还原为Cl-。反应生成的I-用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI。

(1)请写出pH≤2.0时ClO与I-反应的离子方程式:_________________________。
(2)请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中;
步骤2:调节水样的pH为7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL;
步骤5:______________;
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,又消耗Na2S2O3溶液V2 mL。
(3)根据上述分析数据,测得该饮用水中ClO的浓度为________ mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
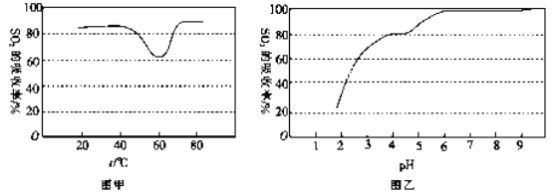
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
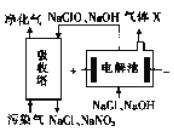
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述正确的是( )
H++CH3COO-,下列叙述正确的是( )
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.10mol/L的CH3COOH溶液中加水稀释,溶液中所有离子的浓度都减小
C. 向溶液中加少量的CH3COONa固体,平衡逆向移动,c(CH3COO-)的浓度减小
D. 25℃时,加入少量浓醋酸,平衡正向移动,醋酸的电离程度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com