
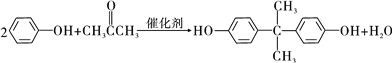
【题目】以烃的含氧衍生物X为主要原科生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A。合成线路如图:
}及阻燃剂四溴双酚A。合成线路如图:

已知:①X的蒸汽密度是相同条价下H2的47倍,遇FeCl3溶液显紫色;
②C为![]() ,
,![]()
③已知X→Y中,CH3COCH3断裂“C=O”键,Y有4种不同环境的H;
④
(1)原料X的分子式为_______;B的名称是_______;B--C的反应类型是_______;D的结构简式为_______ 。
(2)写出X→Y的化学方程式: ______________ 。
(3)1mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗___molNaOH.
(4)符合以下条件的D的同分异构体有__种(不考虑立体异构)。
①含有两个甲基和两种官能团②能使溴的CCl4溶液褪色③能同时发生水解和银镜反应
(5)已知由烯烃直接制备不饱和酯的新方法为![]() ,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图_______。
,写出合成该涂料的反应流程图_______。
【答案】 C6H6O 环己醇 氧化反应 ![]()
 10 10
10 10 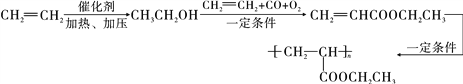
【解析】分析:X的蒸汽密度是相同条件下H2的47倍,其相对分子质量为94,遇FeCl3溶液显紫色,说明含有酚羟基,苯酚的相对分子质量为94,X为![]() ,X和氢气发生加成反应生成B,B为
,X和氢气发生加成反应生成B,B为![]() 。根据已知信息②可知C为
。根据已知信息②可知C为![]() ,则B发生催化氧化反应,PCL为E发生缩聚反应产物,则E结构简式为HO(CH2)5COOH,D发生水解反应然后酸化得到E,则D结构简式为
,则B发生催化氧化反应,PCL为E发生缩聚反应产物,则E结构简式为HO(CH2)5COOH,D发生水解反应然后酸化得到E,则D结构简式为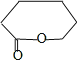 ;根据题给信息④知,X发生取代反应生成Y,Y结构简式为
;根据题给信息④知,X发生取代反应生成Y,Y结构简式为![]() ,四溴双酚A结构简式为
,四溴双酚A结构简式为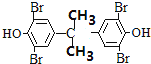 。
。
详解:(1)X为苯酚,其分子式为C6H6O,B为环己醇;B→C是羟基的催化氧化, C生成D的反应是氧化反应,D结构简式为 。
。
(2)X发生取代反应生成Y,反应方程式为![]() ;
;
(3)四溴双酚A能和NaOH溶液发生取代反应后生成的酚羟基、HBr能和NaOH发生中和反应,1mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗10molNaOH;
(4)D结构简式为 ,D的同分异构体符合下列条件:①含有两个甲基和两种官能团,为醛基和羟基或碳碳双键和羟基;②能使溴的CCl4溶液褪色,说明含碳碳双键;③能同时发生银镜反应和水解反应,说明含有HCOO-,符合条件的同分异构体有:HCOOCH2CH=C(CH3)2、HCOOC(CH3)CH=CH2、HCOOCH(CH3)CH=CHCH3、HCOOCH(CH3)C(CH3)=CH2、HCOOCH2C(CH3)=CH2CH3、HCOOC(CH2CH3)=CHCH3、HCOOC(CH3)=C(CH3)CH3、HCOOC(CH3)=CHCH2CH3、HCOOCH=C(CH3)CH3、HCOOCH=CHCH(CH3)2,共10种;
,D的同分异构体符合下列条件:①含有两个甲基和两种官能团,为醛基和羟基或碳碳双键和羟基;②能使溴的CCl4溶液褪色,说明含碳碳双键;③能同时发生银镜反应和水解反应,说明含有HCOO-,符合条件的同分异构体有:HCOOCH2CH=C(CH3)2、HCOOC(CH3)CH=CH2、HCOOCH(CH3)CH=CHCH3、HCOOCH(CH3)C(CH3)=CH2、HCOOCH2C(CH3)=CH2CH3、HCOOC(CH2CH3)=CHCH3、HCOOC(CH3)=C(CH3)CH3、HCOOC(CH3)=CHCH2CH3、HCOOCH=C(CH3)CH3、HCOOCH=CHCH(CH3)2,共10种;
(6)一定条件下乙烯和水发生加成反应生成CH3CH2OH,CH3CH2OH和CH2=CH2、CO、O2反应生成CH2=CHCOOCH2CH3,CH2=CHCOOCH2CH3发生加聚反应生成高分子化合物,其流程图为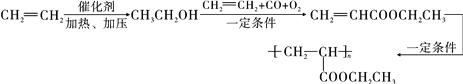 。
。
点晴:该题为高频考点,侧重考查学生分析推断及知识综合应用能力,明确官能团及其性质关系、常见有机反应类型及反应条件是解本题关键,难点是(5)(6)题。有机物的合成是通过化学反应使有机物的碳链增长或缩短,或碳链和碳环的相互转变,或在碳链或碳环上引入或转换各种官能团,以制取不同类型、不同性质的有机物。有机合成题能较全面地考查学生的有机化学基础知识和逻辑思维能力、创造思维能力等,解答时注意知识的迁移灵活应用。


科目:高中化学 来源: 题型:
【题目】下列变化中不可能通过一步反应完成的是( )
A. Fe2O3![]() Fe(OH)3 B. Al2O3
Fe(OH)3 B. Al2O3![]() NaAlO2
NaAlO2
C. Fe![]() Fe3O4 D. Fe(OH)2
Fe3O4 D. Fe(OH)2![]() Fe(OH)3
Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为
(2x)Al2(SO4)3+3xCaCO3+3xH2O![]() 2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
(1)制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有___________________。
(2)碱式硫酸铝溶液吸收SO2过程中,溶液的pH___________(填“增大”、“减小”、“不变”)。
(3)通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O,摩尔质量为183g/mol),受热过程中不同温度范国内分别得到一种固体物质,其质量如下表:
温度范围℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,210℃~290℃过程中产生的气体只有CO2,则290℃~320℃温度范围内的固体物质是
A. CoO B. Co2O3 C. Co3O4 D. Co4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mlbmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法不正确的是
A. b>0.01
B. 混合后溶液呈中性
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系:
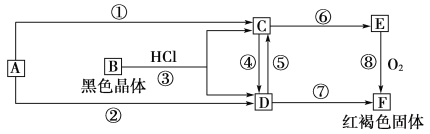
(1)确定A、B、C、D、E、F的化学式,A为________,B为________,C为________,D为________,E为________,F为________。
(2)写出①⑧的化学方程式,④、⑤的离子方程式。
①_________________________________________________,
⑧_________________________________________________,
④________________________________________________,
⑤___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=6.0×10-4,Ksp(MgF2)=5.0×10-11。现向1 L 0.2 mol·L-1 HF溶液中加入 1 L 0.2 mol·L-1 MgCl2溶液。下列说法中正确的是( )
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. 0.2 mol·L-1 MgCl2溶液中离子浓度关系为2c(Mg2+)=c(Cl-)>c(H+)=c(OH-)
C. 2HF(aq)+Mg2+(aq)![]() MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
D. 该反应体系中有MgF2沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机化学中,硫酰氯(SO2Cl2)长用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。
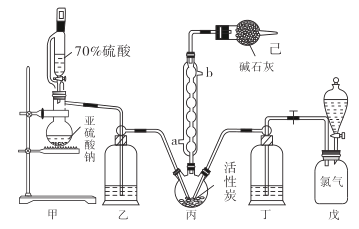
已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置丙中作为反应容器的仪器的名称为_______,装置丙中球形冷凝管的作用是________;如何控制两种反应物体积相等:____________________________________。
(2)装置戊上方分液漏斗中最好选用下列试剂:_________________(选填字母)
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 molL-1盐酸
(3)若缺少装置己,硫酰氯(SO2Cl2)会和空气中的水反应而变质,其化学方程式是______________________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H![]() SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是_________________________________(用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为___________。
(7)请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、W、Q 四种元素在元素周期表中的位置如下,下列叙述错误的是
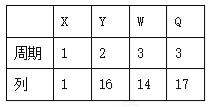
A. Y 的氢化物沸点高于 Q 的氢化物沸点
B. 最高正价与最低负价之和为 0 的元素只有 W
C. 原子半径顺序为:r(W) > r(Q) > r(Y) > r(X)
D. X、Y、Q 三元素形成的分子中,原子最外层电子数之和最大为 32
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com