
【题目】在有机化学中,硫酰氯(SO2Cl2)长用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。
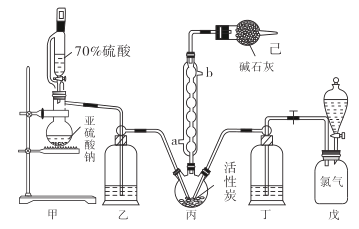
已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置丙中作为反应容器的仪器的名称为_______,装置丙中球形冷凝管的作用是________;如何控制两种反应物体积相等:____________________________________。
(2)装置戊上方分液漏斗中最好选用下列试剂:_________________(选填字母)
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 molL-1盐酸
(3)若缺少装置己,硫酰氯(SO2Cl2)会和空气中的水反应而变质,其化学方程式是______________________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H![]() SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是_________________________________(用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为___________。
(7)请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):___________________________。
【答案】 三颈烧瓶 冷凝回流导气 观察乙、丁导管口产生气泡的速度相等 B SO2Cl2+2H2O==H2SO4+2HCl C SO2Cl2=SO2+Cl2,分解产生少量的氯气溶解在其中 75% 取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸
【解析】分析:用干燥的氯气和二氧化硫制备SO2Cl2,甲是用亚硫酸钠与硫酸反应制备二氧化硫,与氯气在活性炭催化作用下于丙装置内发生反应制备SO2Cl2;乙、丁盛放浓硫酸干燥气体,氯气和二氧化硫不能直接排放到空气中,用已装置中的碱石灰进行吸收。据此回答。
详解:(1)装置丙中作为反应容器的仪器,名称为三颈烧瓶;装置丙中球形冷凝管的作用是冷凝回流导气;通过调节旋塞或滴液的快慢控制气体流速,使装置乙和丁导管口产生气泡的速度相等;正确答案:三颈烧瓶;冷凝回流导气 ; 观察乙、丁导管口产生气泡的速度相等。
(2)A.蒸馏水可以溶解氯气;B.饱和食盐水溶解氯气的能力很小;C.浓氢氧化钠溶液与氯气发生反应;D.6.0 mol·L-1盐酸挥发逸出杂质气体氯化氢;正确选项B。
(3)硫酰氯(SO2Cl2)会和空气中的水反应而变质,生成硫酸和盐酸,化学方程式是:SO2Cl2+2H2O==H2SO4+2HCl;正确答案:SO2Cl2+2H2O==H2SO4+2HCl。
(4)两种产物都呈液态,且沸点差别较大,采用蒸馏方法进行分离,正确选项C。
(5)SO2Cl2=SO2+Cl2,分解产生少量的氯气溶解在其中,会导致硫酰氯会发黄;正确答案: SO2Cl2=SO2+Cl2,分解产生少量的氯气溶解在其中。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),氯气的物质的量为0.04mol,根据反应SO2(g)+ Cl2(g) =SO2Cl2(l)可知,制备出的SO2Cl2的量为0.04mol,质量为0.04×135=5.4g,则硫酰氯的产率为4.05/5.4×100%=75%;正确答案:75%。
(7)由于SO2Cl2+2H2O==H2SO4+2HCl发生,所以要检验SO2Cl2中混有硫酸,就要先除去SO2Cl2,根据题给信息,进行如下操作:取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸。正确答案:取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸。


科目:高中化学 来源: 题型:
【题目】某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃的含氧衍生物X为主要原科生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A。合成线路如图:
}及阻燃剂四溴双酚A。合成线路如图:

已知:①X的蒸汽密度是相同条价下H2的47倍,遇FeCl3溶液显紫色;
②C为![]() ,
,![]()
③已知X→Y中,CH3COCH3断裂“C=O”键,Y有4种不同环境的H;
④
(1)原料X的分子式为_______;B的名称是_______;B--C的反应类型是_______;D的结构简式为_______ 。
(2)写出X→Y的化学方程式: ______________ 。
(3)1mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗___molNaOH.
(4)符合以下条件的D的同分异构体有__种(不考虑立体异构)。
①含有两个甲基和两种官能团②能使溴的CCl4溶液褪色③能同时发生水解和银镜反应
(5)已知由烯烃直接制备不饱和酯的新方法为![]() ,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图_______。
,写出合成该涂料的反应流程图_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是化学常用来定量测定物质浓度的一种重要的实验方法。在食品工业、药品制造、化妆品行业等等都被广泛应用。
(I)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是________,水通入A的进口为________。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。
(2)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为________。滴定终点现象为_______________。
(3)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是_________________,在不改变装置的情况下,如何改进:______________________________________________。
(II)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO)。饮用水中的ClO2、ClO含量可用连续碘量法进行测定。ClO2被I-还原为ClO、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO也能被I-完全还原为Cl-。反应生成的I-用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI。

(1)请写出pH≤2.0时ClO与I-反应的离子方程式:_________________________。
(2)请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中;
步骤2:调节水样的pH为7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL;
步骤5:______________;
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,又消耗Na2S2O3溶液V2 mL。
(3)根据上述分析数据,测得该饮用水中ClO的浓度为________ mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
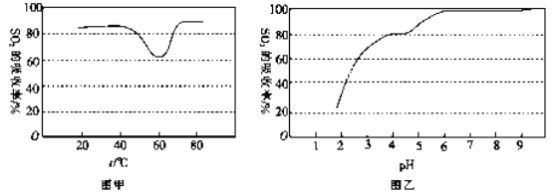
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
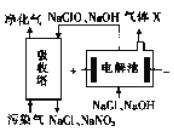
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中,除了22种非金属元素外,其余的都是金属,请根据元素周期表回答下列问题:
I.(1)基态氮原子核外共有_______种运动状态不相同的电子,该原子核外电子排布中电子在能量最低的轨道呈_______形,用n表示能层,氟元素所在族的外围电子排布式为______________。
(2)在元素周期表中,某些主族元素与下方的主族元素的性质有些相似,被称为“对角线规则”,如下表:

根据“对角线规则”写出Be(OH)2与NaOH反应的离子方程式______________,硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图)。含1mol H3BO3的晶体中有__________mol氢键,H3BO3中B原子的杂化类型为_____________。

(3)以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是____________________________________________________。
II.近年来铁及其化合物在工农业中有广阔的应用前景。
(4)铁的一种络离子[Fe(CN)6]4-中Fe2+的配位数为6,该络离子中不存在______(填序号)。
A.共价键 B.非极性键 C.配位键 D.δ键 E.π键
(5)AlCl3的熔点比NaCl熔点低的原因是____________________________________。
(6)一种Al-Fe合金的立体晶胞如图所示。若晶体的密度为ρ gcm-3,则此合金中最近的两个Fe原子之间的距离为__________cm(用含ρ的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法正确的是( )

A. 图1中,插入海水中的铁棒,越靠近底端,腐蚀越严重
B. 镀层破损后,镀锌铁比镀锡铁更耐用
C. 纯银器表面在空气中因电化学腐蚀渐渐变暗
D. 图2中,金属棒X若为Cu,可使埋在地下的钢管免受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe+H2SO4 , B管中是NaOH溶液,请回答下列问题。
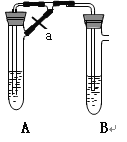
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 。
(2)同学乙:打开a,使A管中反应一段时间再 夹紧止水夹a,实验中在B管中观察到的现象是 ,B中发生反应的离子方程式为
(3)同学乙打开a的目的 ; (填甲或乙)同学可成功。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com