
【题目】元素周期表中,除了22种非金属元素外,其余的都是金属,请根据元素周期表回答下列问题:
I.(1)基态氮原子核外共有_______种运动状态不相同的电子,该原子核外电子排布中电子在能量最低的轨道呈_______形,用n表示能层,氟元素所在族的外围电子排布式为______________。
(2)在元素周期表中,某些主族元素与下方的主族元素的性质有些相似,被称为“对角线规则”,如下表:

根据“对角线规则”写出Be(OH)2与NaOH反应的离子方程式______________,硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图)。含1mol H3BO3的晶体中有__________mol氢键,H3BO3中B原子的杂化类型为_____________。

(3)以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是____________________________________________________。
II.近年来铁及其化合物在工农业中有广阔的应用前景。
(4)铁的一种络离子[Fe(CN)6]4-中Fe2+的配位数为6,该络离子中不存在______(填序号)。
A.共价键 B.非极性键 C.配位键 D.δ键 E.π键
(5)AlCl3的熔点比NaCl熔点低的原因是____________________________________。
(6)一种Al-Fe合金的立体晶胞如图所示。若晶体的密度为ρ gcm-3,则此合金中最近的两个Fe原子之间的距离为__________cm(用含ρ的代数式表示)。

【答案】 7 球形 ns2np5 Be(OH)2+2OH-=BeO22-+2H2O 3 sp2 从左到右,随着核电荷数增加,原子半径逐渐减小,原子核对外层价电子的吸引能力逐渐增大,故元素的第一电离能从左到右逐渐增大 B AlCl3是分子晶体,NaCl是离子晶体 ![]()
【解析】Ⅰ.(1)基态氮原子核外7个电子,每个电子运动状态不同,共有7种运动状态不相同的电子,该原子核外电子排布中电子在能量最低的轨道1s,呈球形型,用n表示能层,F元素所在族的外围电子排布式为ns2np5。(2)Be(OH)2和氢氧化铝一样,具有两性,能溶于强碱,Be(OH)2+ 2OH- = BeO22-+2H2O;每个硼酸分子有6个氢键,每个氢键两个硼酸共同拥的一个氢键,含1mol H3BO3的晶体中有3mol氢键,H3BO3中B原子形成3个δ键,无孤电子对,杂化类型为sp2 ;(3)以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是从左到右,随着核电荷数增加,原子半径逐渐减小,原子核对外层价电子的吸引能力逐渐增大,故元素的第一电离能从左到右逐渐增大;(4)[Fe(CN)6]4-中存在A.共价键,如C-N键;C.配位键,如中心原子与CN-间;D.σ键,如C-N键; E. π键,如碳氮叁键;由于没有相同原子形成的共价键,不存在 B.非极性键;故选B。(5)AlCl3的熔点比NaCl熔点低的原因是:AlCl3是分子晶体,NaCl是离子晶体;一个晶胞中含有8个Fe原子和4个Al原子,晶胞的质量为(56×8+27×4)/NAg, 棱长为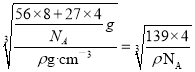 cm,个最近的2个Fe原子之间的距离为。
cm,个最近的2个Fe原子之间的距离为。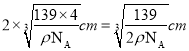


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某科研小组将含硫化氢的工业废气进行了资源化利用,将获得的电能用于制取“84”消毒液。已知:2H2S(g)+O2(g)= S2(s)+2H2O(1)ΔH=-632kJ·mol-1。下图为该小组设计的原理图。下列说法正确的是

A. 电极a 为燃料电池正极
B. 电极b上发生的电极反应为:O2+4e-+2H2O= 4OH-
C. 电路中每流过4mol 电子,电池内部释放热能小于632 kJ
D. a极每增重32g,导气管e 将收集到气体22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的叙述中,错误的是
A.碳酸钠溶液保存在配有橡胶塞的细口瓶中,氢氟酸通常保存在塑料瓶中
B.石灰石是制备玻璃、水泥的原料之一
C.水泥、玻璃、青花瓷、水晶、玛瑙都属于硅酸盐工业产品
D.合金比它的各成分金属的熔点低,硬度大,电解氧化铝可以获得铝单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示 (用强酸性溶液作电解质溶液)。下列说法中不正确的是
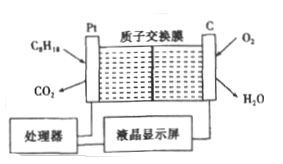
A. 石量电极作正极,电极表面有物质被还原
B. 铂电极的电极反应式为: C8H18+16H2O-50e-=8CO2+50H+
C. H+由质子交换膜左侧向右侧迁移
D. 标况下每消耗5.6 L O2电路中通过1mol 电子,经过电解质形成闭合回路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的课本实验。玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,待钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )

A. 反应生成的大量白烟是氯化钠晶体
B. 浸有NaOH溶液的棉花球用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 在棉花球外沿滴一滴石蕊溶液,判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 硫酸铁中加入少量氨水:Fe3++3OH-=Fe(OH)3↓
B. 电解饱和食盐水:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
D. 将铝投入CuSO4溶液中:Al+Cu2+=Cu+Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断中一定正确的是( )
A. NaCl及Na2O2固体中阴、阳离子数之比均为1:1
B. 等质量的O2与O3中,氧原子的个数比为3:2
C. 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2
D. 10 mL 0.3 mol·L-1 NaCl溶液与30 mL 0.1 mol·L-1 AlCl3溶液中Cl -物质的量浓度比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到过量的1 mol·L-1盐酸中,待合金完全溶解后,再往溶液里加入1 mol·L-1NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示,下列说法中错误的是( )
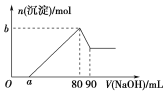
A. 盐酸的体积为90 mL
B. a的取值范围为0<a<50
C. n(Mg2+)<0.025 mol
D. 当a值为30时,b值为0.02
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com