
【题目】X、Y、W、Q 四种元素在元素周期表中的位置如下,下列叙述错误的是
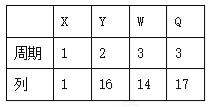
A. Y 的氢化物沸点高于 Q 的氢化物沸点
B. 最高正价与最低负价之和为 0 的元素只有 W
C. 原子半径顺序为:r(W) > r(Q) > r(Y) > r(X)
D. X、Y、Q 三元素形成的分子中,原子最外层电子数之和最大为 32
科目:高中化学 来源: 题型:
【题目】以烃的含氧衍生物X为主要原科生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A。合成线路如图:
}及阻燃剂四溴双酚A。合成线路如图:

已知:①X的蒸汽密度是相同条价下H2的47倍,遇FeCl3溶液显紫色;
②C为![]() ,
,![]()
③已知X→Y中,CH3COCH3断裂“C=O”键,Y有4种不同环境的H;
④
(1)原料X的分子式为_______;B的名称是_______;B--C的反应类型是_______;D的结构简式为_______ 。
(2)写出X→Y的化学方程式: ______________ 。
(3)1mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗___molNaOH.
(4)符合以下条件的D的同分异构体有__种(不考虑立体异构)。
①含有两个甲基和两种官能团②能使溴的CCl4溶液褪色③能同时发生水解和银镜反应
(5)已知由烯烃直接制备不饱和酯的新方法为![]() ,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图_______。
,写出合成该涂料的反应流程图_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中,除了22种非金属元素外,其余的都是金属,请根据元素周期表回答下列问题:
I.(1)基态氮原子核外共有_______种运动状态不相同的电子,该原子核外电子排布中电子在能量最低的轨道呈_______形,用n表示能层,氟元素所在族的外围电子排布式为______________。
(2)在元素周期表中,某些主族元素与下方的主族元素的性质有些相似,被称为“对角线规则”,如下表:

根据“对角线规则”写出Be(OH)2与NaOH反应的离子方程式______________,硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图)。含1mol H3BO3的晶体中有__________mol氢键,H3BO3中B原子的杂化类型为_____________。

(3)以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是____________________________________________________。
II.近年来铁及其化合物在工农业中有广阔的应用前景。
(4)铁的一种络离子[Fe(CN)6]4-中Fe2+的配位数为6,该络离子中不存在______(填序号)。
A.共价键 B.非极性键 C.配位键 D.δ键 E.π键
(5)AlCl3的熔点比NaCl熔点低的原因是____________________________________。
(6)一种Al-Fe合金的立体晶胞如图所示。若晶体的密度为ρ gcm-3,则此合金中最近的两个Fe原子之间的距离为__________cm(用含ρ的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法正确的是( )

A. 图1中,插入海水中的铁棒,越靠近底端,腐蚀越严重
B. 镀层破损后,镀锌铁比镀锡铁更耐用
C. 纯银器表面在空气中因电化学腐蚀渐渐变暗
D. 图2中,金属棒X若为Cu,可使埋在地下的钢管免受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700 -900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
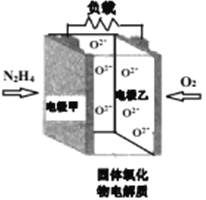
A. 电池内的O2-由电极乙移向电极甲
B. 电池总反应为N2H4+2O2= 2NO+2H2O
C. 当甲电极上有lmol N2H4消耗时,乙电极上有22.4LO2参与反应
D. 电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述正确的是( )
H++CH3COO-,下列叙述正确的是( )
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.10mol/L的CH3COOH溶液中加水稀释,溶液中所有离子的浓度都减小
C. 向溶液中加少量的CH3COONa固体,平衡逆向移动,c(CH3COO-)的浓度减小
D. 25℃时,加入少量浓醋酸,平衡正向移动,醋酸的电离程度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaBH4和H2O2作原料的燃料电池,可用作空军通信卫星。电池负极材料采用Pt/C,正极材料采用MnO2,其工作原理如下图所示。下列说法错误的是

A. 电池放电时Na+从a极区移向b极区
B. 电极b采用Pt/C,该极溶液的pH增大
C. 该电池a极的反应为BH4-+8OH--8e-===BO2-+6H2O
D. 电池总反应:BH4- + 4H2O2 === BO2- + 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe+H2SO4 , B管中是NaOH溶液,请回答下列问题。
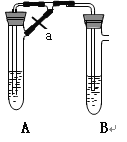
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 。
(2)同学乙:打开a,使A管中反应一段时间再 夹紧止水夹a,实验中在B管中观察到的现象是 ,B中发生反应的离子方程式为
(3)同学乙打开a的目的 ; (填甲或乙)同学可成功。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com