
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:

(1)配平反应的化学方程式为:___Zn + ___H2SO4(浓) = ___ZnSO4 ___SO2 ↑+ ___H2O。
(2)丙同学在安装好装置后,必不可少的一步操作是_________________________。
(3)A中加入的试剂可能是___________溶液;
B中加入的试剂可能是____________;
C中发现黑色固体变成红色,加入的试剂可能是____________。
D中加入的试剂可能是____________。
E中加入的试剂可能是____________。
【答案】1 2 1 1 2 检查装置的气密性 品红 浓硫酸 CuO CuSO4 碱石灰
【解析】
(1)锌和浓硫酸反应是二氧化硫、硫酸锌和水;
(2)装置是气体验证实验,所以需要装置气密性完好;
(3)分析装置图可以知道,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中 的无水硫酸铜检验水的生成,为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰。
(1)锌和浓硫酸反应是二氧化硫、硫酸锌和水,反应的化学方程式为Zn + 2H2SO4(浓) ![]() ZnSO4 SO2 ↑+ 2H2O ,
ZnSO4 SO2 ↑+ 2H2O ,
因此,本题正确答案是:1 ;2 ;1;1 ;2;
(2)装置是气体验证实验,所以需要装置气密性完好,实验开始先检验装置的气密性,
因此,本题正确答案是;检查装置的气密性;
(3)分析装置图可以知道,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中的无水硫酸铜检验水的生成,为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰,
因此,本题正确答案是:品红;浓硫酸;CuO;CuSO4 ;碱石灰。


科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1) CO2的重整用CO2和H2为原料可得到CH4燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247k/mol
②CH4 (g)+H2O(g)=CO(g)+3H2(g) △H2=+205k/mol
写出CO2重整的热化学方程式:___________________________。
(2)“亚碳酸盐法”吸收烟中的SO2
①将烟气通入1.0mol/L 的Na2SO3溶液,若此过程中溶液体积不变,则溶液的pH不断___(填“减小”“不变”或“增大)。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂,此时溶液中c(SO32-) =0.2 mol/L,则溶液中c(HSO3-) =_______。
②室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与各组分物质的量分数的变化关系如图:
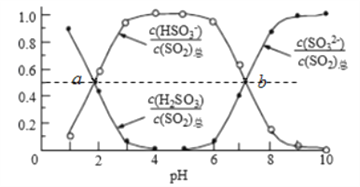
b点时溶液pH=7,则n(NH4+):n(HSO3-)=__________。
(3)催化氧化法去除NO。一定条件下,用NH3消除NO污染,其反应原理; 4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如下图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如下图所示:
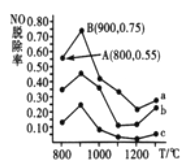
①曲线a中,NO的起始浓度为6×10-4mg·m-3,从A点到B点经过0.8s,该时间段内NO的脱除速率为___________mg·m-3·s-1。
②曲线b对应NH3与NO的物质的量之比是____________________。
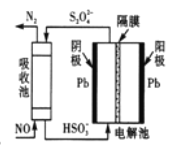
(4)间接电化学法除NO。其原理如图所示:写出阴极的电极反应式(阴极室溶液呈酸性)______。吸收池中除去NO的原理_____________ (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )

A. Ka1(H2X)的数量级为10-5
B. 曲线N表示pH与![]() 的变化关系
的变化关系
C. NaHX溶液显碱性
D. 当混合溶液呈中性时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。

回答下列问题:
(1)硬质试管中发生反应的化学方程式为____________________________ ;
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分一定有________,若溶液未变红色则说明硬质试管中固体物质的成分一定有__________________;原因是:___________________________(用离子方程式表示);
(3)发现溶液未变红该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与沉淀发生变化现象的反应的化学方程式:_____________________;

(4)一段时间后,该同学发现(2)中未变红的溶液变成红色,说明Fe2+ 具有_______性;由此可知,实验室中FeSO4溶液要临时配制并加少量___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。右图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。右图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是
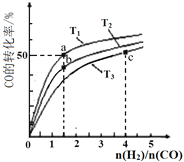
A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡向正方向移动
D. c点状态下再通入1 molCO和4 mol H2,新平衡中CH3OH的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置模拟石灰石燃煤烟气脱硫实验:

(1)实验中为提高石灰石浆液脱硫效率采取的措施是____,写出通入SO2和空气发生反应生成石膏(CaSO4·2H2O)的化学方程式____。
(2)将脱硫后的气体通入KMnO4溶液,可粗略判断烟气脱硫效率的方法是____。
(3)研究发现石灰石浆液的脱硫效率受pH和温度的影响。烟气流速一定时,脱硫效率与石灰石浆液pH的关系如图所示,在为5.7时脱硫效果最佳,石灰石浆液5.7<pH<6.0时,烟气脱硫效果降低的可能原因是____,烟气通入石灰石浆液时的温度不宜过高,是因为____。

(4)石灰石烟气脱硫得到的物质中的主要成分是CaSO4和CaSO3,实验人员欲测定石灰石浆液脱硫后的物质中CaSO3的含量,以决定燃煤烟气脱硫时通入空气的量。请补充完整测定CaSO3含量的实验方案:取一定量石灰石烟气脱硫后的物质,____。[浆液中CaSO3能充分与硫酸反应。实验中须使用的药品:75%的硫酸、标准浓度的(NH4)2Fe(SO4)2溶液,标准浓度的酸性KMnO4溶液]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如下所示化合物的说法不正确的是( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素(H2NCONH2)直接转化为对环境友好物质的原电池装置。现利用甲装置产生的电能对乙装置中的饱和食盐水进行电解(A、B皆为石墨电极)。下列说法中不正确的是( )

①M电极反应式:H2NCONH2+H2O+6e-=CO2↑+N2↑+6H+
②当A电极产生11.2mL气体(标况)时,则N电极消耗25×10-4mol气体
③甲中H+透过质子交换膜由右向左移动
④A电极应与X相连接
⑤反应一段时间后,乙装置U型管中的溶液pH变大
A. ①③ B. ①③⑤ C. ①②③ D. ②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com