
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )

A. Ka1(H2X)的数量级为10-5
B. 曲线N表示pH与![]() 的变化关系
的变化关系
C. NaHX溶液显碱性
D. 当混合溶液呈中性时, ![]()
【答案】A
【解析】A、己二酸是二元弱酸,Ka1=![]() ,曲线N表示pH与
,曲线N表示pH与![]() 的变化关系,当
的变化关系,当![]() =0时,
=0时,![]() =1,Ka1=
=1,Ka1= ![]() 10–4.4,因此Ka1(H2X)的数量级为10–5,选项A正确;B.根据以上分析可知曲线N表示pH与
10–4.4,因此Ka1(H2X)的数量级为10–5,选项A正确;B.根据以上分析可知曲线N表示pH与![]() 的关系,选项B错误;C.曲线N是己二酸的第一步电离,根据图像取0.6和5.0点,
的关系,选项B错误;C.曲线N是己二酸的第一步电离,根据图像取0.6和5.0点,![]() =100.6 mol·L-1,c(H+)=10-5.0 mol·L-1,代入Ka1得到Ka1=10-4.4,因此HX-的水解常数是
=100.6 mol·L-1,c(H+)=10-5.0 mol·L-1,代入Ka1得到Ka1=10-4.4,因此HX-的水解常数是![]() =10-14/10-4.4<Ka2,所以NaHX溶液显酸性,即c(H+)>c(OH-),选项C错误;D.根据图像可知当
=10-14/10-4.4<Ka2,所以NaHX溶液显酸性,即c(H+)>c(OH-),选项C错误;D.根据图像可知当![]() =0时溶液显酸性,因此当混合溶液呈中性时,
=0时溶液显酸性,因此当混合溶液呈中性时,![]() >0,即c(X2–)>c(HX–),选项D错误;答案选A。
>0,即c(X2–)>c(HX–),选项D错误;答案选A。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列关于铁及其化合物的说法正确的是
A.铁与CuSO4溶液反应后滴加KSCN溶液,溶液变红
B.FeCl2既有氧化性又有还原性
C.除去FeCl2溶液中的少量氯化铁,可通入氯气
D.补铁保健品中,含有+3价的铁元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
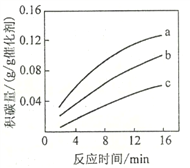
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。某兴趣小组用右图模拟该电池工作原理。已知甲池的总反应式为:2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O。请填空:
2K2CO3+6H2O。请填空:
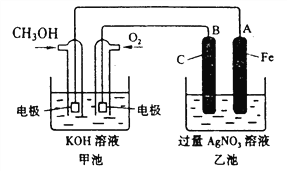
(1)充电时:①原电池的负极与电源_______极相连。
②阳极的电极反应式为____________________________________________。
(2)放电时:负极的电极反应式为_______________________________________________。
(3)某兴趣小组的同学用如图装置进行如下实验:在此过程中若完全反应,乙池中A极的质量升高648g,则甲池中理论上消耗O2 的体积为________L(标准状况下)。
(4)已知常温时CuS的Ksp=1.3×10-36,向100 mL 2×10-18 mol·L-1的K2S溶液中加入100 mL 2×10-18 mol·L-1的CuCl2溶液,试通过计算说明有无CuS沉淀生成(写出计算推理过程,忽略溶液混合时的体积变化)_____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在一定条件下aA+bB![]() cC+dD达到平衡时,请填写:
cC+dD达到平衡时,请填写:
(1)若A、B、C、D都是气体,在加压后平衡向逆反应方向移动,则a、b、c、d关系是__________________。
(2)已知B、C、D是气体,现增加A的物质的量,平衡不移动,说明A是__________________(填状态)。
(3)若容器容积不变,加入气体B,气体A的转化率__________________(填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量减小,则正反应是__________________反应(填“放热”或“吸热”)。
(5)若保持容器压强不变,且A、B、C、D都是气体,向容器中充入稀有气体,则化学平衡正向移动,则a、b、c、d关系是__________________。
Ⅱ.工业上一般采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
(1)在一定温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.5mol·L-1。该反应的平衡常数K=__________________。
(2)若在一体积可变的容器中充入l molCO、 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________________(填“正”、“逆”)反应方向移动。
(3)若在温度和容积相同的三个密闭容器中,按不同方式投人反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度(mol/L) | 能量变化(Q1、Q2、Q3均大于0) |
1 | 2molCO和4molH2 | a1% | c1 | 放出Q1kJ热量 |
2 | 2molCH3OH | a2% | c2 | 吸收Q2kJ热量 |
3 | 4molCO和8molH2 | a3% | c3 | 放出Q3kJ热量 |
则下列关系正确的是 __________________。
A. c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1 +a2 =1 E.该反应若生成2mol CH3OH,则放出(Q1+Q2)kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:

(1)配平反应的化学方程式为:___Zn + ___H2SO4(浓) = ___ZnSO4 ___SO2 ↑+ ___H2O。
(2)丙同学在安装好装置后,必不可少的一步操作是_________________________。
(3)A中加入的试剂可能是___________溶液;
B中加入的试剂可能是____________;
C中发现黑色固体变成红色,加入的试剂可能是____________。
D中加入的试剂可能是____________。
E中加入的试剂可能是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素形成的酸有硝酸、亚硝酸(HNO2)等,其中HNO2为一元弱酸。
(1)写出HNO2溶液与NaOH溶液反应的离子方程式:___________________。
(2)亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应:2NaNO2 + 4HI ═ 2NO↑ + 2NaI + I2 + 2H2O
①用双线桥标出该反应的电子转移方向及个数。______
②该反应被氧化的元素是_____,其中被氧化的元素占该元素总量的______(填百分数)。
(3)硝酸盐可作为烟幕弹。如反应:NH4NO3+Zn=ZnO+N2↑+2H2O,反应中NH4NO3作为_____(填选项)
A.氧化剂 B.还原剂 C.既做氧化剂又做还原剂
(4)实验室需配制0.1molL﹣1的NH4NO3溶液500mL。
①配制时,应用托盘天平称取NH4NO3的质量为_________。
②配制中已有托盘天平(带砝码和镊子)、烧杯、药匙、玻璃棒,还需要的玻璃仪器有_________。
③定容时俯视刻度线,所配得溶液的浓度_____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com