
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1) CO2的重整用CO2和H2为原料可得到CH4燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247k/mol
②CH4 (g)+H2O(g)=CO(g)+3H2(g) △H2=+205k/mol
写出CO2重整的热化学方程式:___________________________。
(2)“亚碳酸盐法”吸收烟中的SO2
①将烟气通入1.0mol/L 的Na2SO3溶液,若此过程中溶液体积不变,则溶液的pH不断___(填“减小”“不变”或“增大)。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂,此时溶液中c(SO32-) =0.2 mol/L,则溶液中c(HSO3-) =_______。
②室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与各组分物质的量分数的变化关系如图:
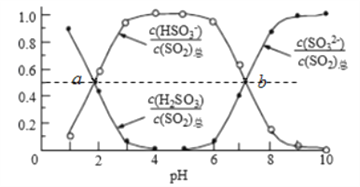
b点时溶液pH=7,则n(NH4+):n(HSO3-)=__________。
(3)催化氧化法去除NO。一定条件下,用NH3消除NO污染,其反应原理; 4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如下图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如下图所示:
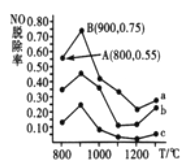
①曲线a中,NO的起始浓度为6×10-4mg·m-3,从A点到B点经过0.8s,该时间段内NO的脱除速率为___________mg·m-3·s-1。
②曲线b对应NH3与NO的物质的量之比是____________________。
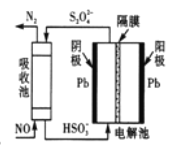
(4)间接电化学法除NO。其原理如图所示:写出阴极的电极反应式(阴极室溶液呈酸性)______。吸收池中除去NO的原理_____________ (用离子方程式表示)。
【答案】 CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H1=-163kJ/mo1 减少 1.6mol/L 3:1 1.5×10-4 3:1 2HSO3-+2e-+2H+=S2O42-+2H2O 2NO+2S2O42-+2H2O=N2+4HSO3-
【解析】(1)已知:①CH4 (g)+CO2(g)=2CO(g)+2H2(g)△H1=+247k/mol
②CH4 (g)+H2O(g)=CO(g)+3H2(g)△H2=+205k/mol
根据盖斯定律,由①-②![]() 2得反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=△H1-2△H2=-163kJ/mo1;(2)①将烟气通入1.0mol/L的Na2SO3溶液,亚硫酸与亚硫酸钠和水反应生成亚硫酸氢钠,溶液pH不断减小;向亚硫酸钠溶液中通入二氧化硫生成亚硫酸氢钠,反应方程式SO2+ Na2SO3+2H2O = 2NaHSO3,溶液中反应的亚硫酸根离子和生成亚硫酸氢根离子的物质的量比为1:2,即溶液中参加反应的亚硫酸根为(1.0-0.2)mol/L,则生成的亚硫酸氢根为c(HSO3-)=2×(1.0-0.2)mol/L=1.6 mol/L;②发生的主要反应(NH4)2SO3+ SO2+H2O =2NH4HSO3,根据图像可知a点时两个比值相等,则n(HSO3-):n(H2SO3)=1:1,b点时溶液pH=7,根据电荷守恒可知n(NH4+)=n(HSO3-)+2n(SO32-),又根据图像曲线可知n(HSO3-)+n(SO32-),则n(NH4+):n(HSO3-)=(1+2):1=3:1;(3) ①曲线a中,NO的起始浓度为6×10-4mg·m-3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8s,该时间段内NO的脱除速率为6×10-4mg·m-3×(0.75-0.55)÷0.8s=1.5×10-4mg·m-3·s-1;②NH3与NO的物质的量的比值越大,NO的脱除率越大,故其物质的量之比分别为4:1、3:1、1:3时,对应的曲线为a、b、c,故曲线b对应的物质的量之比是3:1;(4)阴极是HSO3-在酸性条件下发生还原反应,生成S2O42-,其电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O;根据图示,吸收池中S2O42-和NO是反应物,N2和HSO3-是生成物,则吸收池中除去NO的原理是2NO+2S2O42-+2H2O=N2+4HSO3-。
2得反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=△H1-2△H2=-163kJ/mo1;(2)①将烟气通入1.0mol/L的Na2SO3溶液,亚硫酸与亚硫酸钠和水反应生成亚硫酸氢钠,溶液pH不断减小;向亚硫酸钠溶液中通入二氧化硫生成亚硫酸氢钠,反应方程式SO2+ Na2SO3+2H2O = 2NaHSO3,溶液中反应的亚硫酸根离子和生成亚硫酸氢根离子的物质的量比为1:2,即溶液中参加反应的亚硫酸根为(1.0-0.2)mol/L,则生成的亚硫酸氢根为c(HSO3-)=2×(1.0-0.2)mol/L=1.6 mol/L;②发生的主要反应(NH4)2SO3+ SO2+H2O =2NH4HSO3,根据图像可知a点时两个比值相等,则n(HSO3-):n(H2SO3)=1:1,b点时溶液pH=7,根据电荷守恒可知n(NH4+)=n(HSO3-)+2n(SO32-),又根据图像曲线可知n(HSO3-)+n(SO32-),则n(NH4+):n(HSO3-)=(1+2):1=3:1;(3) ①曲线a中,NO的起始浓度为6×10-4mg·m-3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8s,该时间段内NO的脱除速率为6×10-4mg·m-3×(0.75-0.55)÷0.8s=1.5×10-4mg·m-3·s-1;②NH3与NO的物质的量的比值越大,NO的脱除率越大,故其物质的量之比分别为4:1、3:1、1:3时,对应的曲线为a、b、c,故曲线b对应的物质的量之比是3:1;(4)阴极是HSO3-在酸性条件下发生还原反应,生成S2O42-,其电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O;根据图示,吸收池中S2O42-和NO是反应物,N2和HSO3-是生成物,则吸收池中除去NO的原理是2NO+2S2O42-+2H2O=N2+4HSO3-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于铁及其化合物的说法正确的是
A.铁与CuSO4溶液反应后滴加KSCN溶液,溶液变红
B.FeCl2既有氧化性又有还原性
C.除去FeCl2溶液中的少量氯化铁,可通入氯气
D.补铁保健品中,含有+3价的铁元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是

①m+n>p ②x点表示的正反应速率大于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A. ①②⑤ B. 只有②④ C. 只有①③ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:
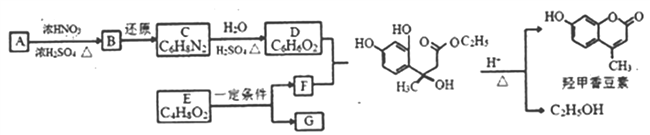 己知:(1)
己知:(1)![]()
(2)2CH3COOCH3 ![]() CH3COCH2COOCH3+CH3OH
CH3COCH2COOCH3+CH3OH
(3)RCOOR'+R"OH ![]() RCOOR"+ R'OH(R、R'、R"代表烃基)
RCOOR"+ R'OH(R、R'、R"代表烃基)
(4)有机物G的红外光谱和核磁共振氢谱如下图所示
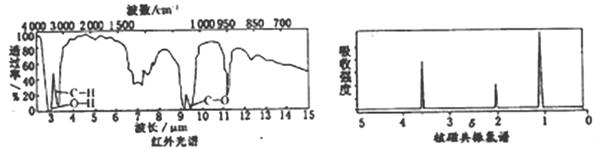
回答下列问题:
(1)A→B的反应类型___________,D的名称为_________________。
(2)C分子中可能共平面的最多原子数目是__________;E中含氧官能团名称____________。
(3)2E→F+G,化学方程式为______________________________。
(4)H为物质F的同分异构体,能发生水解反应,且0.1molH与银氨溶液发生反应后生成43.2g银。符合上述条件的共有_____种。
(5)以CH3COOCH3和苯酚为原料,制备 的合成路线(其他试剂任选) _____
的合成路线(其他试剂任选) _____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
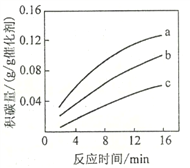
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:

(1)配平反应的化学方程式为:___Zn + ___H2SO4(浓) = ___ZnSO4 ___SO2 ↑+ ___H2O。
(2)丙同学在安装好装置后,必不可少的一步操作是_________________________。
(3)A中加入的试剂可能是___________溶液;
B中加入的试剂可能是____________;
C中发现黑色固体变成红色,加入的试剂可能是____________。
D中加入的试剂可能是____________。
E中加入的试剂可能是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com