
【题目】能正确反映温度和酶催化效率关系的是( )
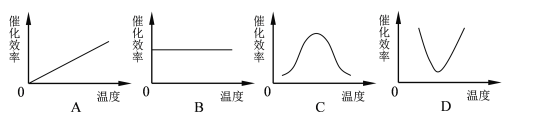
A. A B. B C. C D. D
【答案】C
【解析】
试题影响酶活性的因素主要有:温度、pH等.温度(pH)能影响酶活性,在最适温度(pH)前,随着温度(pH)的升高,酶活性增强;到达最适温度(pH)时,酶活性最强;超过最适温度(pH)后,随着温度(pH)的升高,酶活性降低.另外低温不会使酶变性失活,但高温、过酸或过碱都会使酶变性失活.据此答题.
解:酶的催化效率与温度关系为:在最适温度前,随着温度的升高,酶活性逐渐增强,其催化效率逐渐增大;到达最适温度时,酶活性最强,此时催化效率最高;超过最适温度后,随着温度的升高,酶活性逐渐降低,其催化效率也逐渐降低.由此可见,能正确反映酶的催化效率与温度关系的是C曲线.
故选:C.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:
(1)磷酸是三元中强酸,将磷酸加强热时可发生分子间的脱水生成焦磷酸(H4P2O7)、三聚磷酸(H5P3O10)以至直链多聚磷酸.当直链多聚磷酸分子中P原子数为20时,其化学式是_________.直链多聚磷酸常用于制取阻燃剂
(2)PH3是一种性能良好的熏蒸剂,用于除治储藏物害虫.
①与同主族元素的氢化物NH3相比,沸点:PH3 ___NH3(填“<”或“>”或“=”);稳定性:PH3 __NH3(填“<”、“>”或“=”); 实验室制取PH3可选用PH4I与______(填物质类别)反应得到.
②PH3气体发生器中常用磷化铝水解,其化学反应方程式是_____________.
(3)利用葡萄糖与银氨溶液反应在热水瓶胆内壁镀银.查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)Ag(NH3)2+(aq),该反应平衡常数K稳[Ag(NH3)2+]=1.10×107,又已知Ksp[AgCl]=1.45×10﹣20.计算可逆反应AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl﹣(aq)的化学平衡常数K=________(保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl____mol(保留2位有效数字).
(4)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
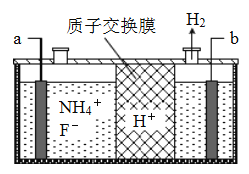
a电极为电解池的___(填“阴”或“阳”)极,其电极反应式为____________________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量盐酸,平衡逆向移动,c(OH-)增大
D.将水加热,Kw增大,pH不变,呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A. 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH)=c(K+)>c(Ba2+)
B. 将10 mL 0.1 mol·L-1Na2CO3溶液逐滴滴加到10 mL 0.1 mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO)>c(CO![]() )
)
C. 向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH)+c(Na+)=c(HCO)+c(CO![]() )
)
D. 0.2 mol·L-1的某一元弱酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是化学常用来定量测定物质浓度的一种重要的实验方法。在食品工业、药品制造、化妆品行业等等都被广泛应用。
(I)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是________,水通入A的进口为________。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。
(2)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为________。滴定终点现象为_______________。
(3)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是_________________,在不改变装置的情况下,如何改进:______________________________________________。
(II)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO)。饮用水中的ClO2、ClO含量可用连续碘量法进行测定。ClO2被I-还原为ClO、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO也能被I-完全还原为Cl-。反应生成的I-用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI。

(1)请写出pH≤2.0时ClO与I-反应的离子方程式:_________________________。
(2)请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中;
步骤2:调节水样的pH为7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL;
步骤5:______________;
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,又消耗Na2S2O3溶液V2 mL。
(3)根据上述分析数据,测得该饮用水中ClO的浓度为________ mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
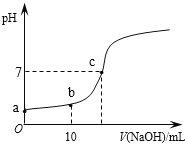
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
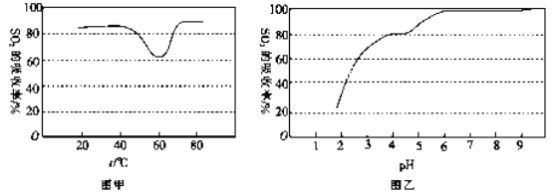
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
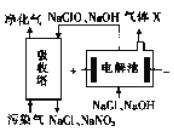
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;
②2SO2+SeO2+2H2O===Se+2SO42—+4H+。
(1) Se与浓H2SO4的反应中,氧化剂是________________,还原剂是_______________。当有标准状况下22.4 L SO2气体生成时,转移电子的物质的量是________ mol。
(2)依据反应①、②判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是______________________。
(3)用单线桥法标出反应②电子转移的方向和数目:_____________________________。
(4)SeO2、KI和HNO3发生如下反应:SeO2+KI+HNO3―→Se+I2+KNO3+H2O配平上述反应的化学方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加wg。在①H2;②CO;③CO和H2的混合物 ④HCHO;⑤CH3COOH;⑥HO-CH2-CH2-OH中,符合题意的是
A. 均不符合 B. 只有①②③ C. 只有④⑤ D. 全部符合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com