
【题目】写出下列物质变化的化学方程式。并按要求填空
(1)用硝酸银溶液检验氯化钠_______________。
(2)铁丝在氯气中燃烧,标出电子转移方向和数目________,氧化剂________,还原剂_____。
(3)氯气通入碘化钾溶液中,标出电子转移方向和数目______,氧化剂________,还原剂_____。
(4)用二氧化锰和浓盐酸反应制取氯气__________________,其中二氧化锰发生了_____(填‘氧化’或‘还原’)反应;盐酸是_____(填‘氧化’或‘还原’)剂,其中每4 mol HCl中只有__mol发生了_____(填‘氧化’或‘还原’)反应。
【答案】AgNO3+NaCl=NaNO3+AgCl↓ Cl2Fe
Cl2Fe Cl2KIMnO2+4HCl(浓)
Cl2KIMnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O还原还原2氧化
MnCl2+Cl2↑+2H2O还原还原2氧化
【解析】
(1)用硝酸银溶液检验氯化钠产生氯化银白色沉淀,反应的化学方程式为AgNO3+NaCl=NaNO3+AgCl↓。
(2)铁丝在氯气中燃烧生成氯化铁,铁元素化合价从0价升高到+3价,失去3个电子,铁是还原剂,氯元素化合价从0价降低到-1价,得到1个电子,氯气是氧化剂,根据电子得失守恒可知电子转移方向和数目可表示为 。
。
(3)氯气通入碘化钾溶液中生成氯化钾和单质碘,氯元素化合价从0价降低到-1价,得到1个电子,氯气是氧化剂,碘元素化合价从-1价升高到0价,失去1个电子,碘化钾是还原剂,则根据电子得失守恒可知电子转移方向和数目可表示为 。
。
(4)用二氧化锰和浓盐酸反应制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其中Mn元素化合价从+4价降低到+2价,得到2个电子,二氧化锰发生了还原反应;氯元素化合价从-1价升高到0价,失去1个电子,则氯化氢是还原剂。反应中还生成氯化锰,则根据方程式可知每4 mol HCl中只有2 mol发生了氧化反应。
MnCl2+Cl2↑+2H2O,其中Mn元素化合价从+4价降低到+2价,得到2个电子,二氧化锰发生了还原反应;氯元素化合价从-1价升高到0价,失去1个电子,则氯化氢是还原剂。反应中还生成氯化锰,则根据方程式可知每4 mol HCl中只有2 mol发生了氧化反应。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如下图所示,有关其性质叙述不正确的是

A. 1mol该有机物能与5mol H2反应
B. 该有机物分子式为C10H8O5
C. 该有机物能发生加成;氧化,取代等反应
D. 分子中有四种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A. 在常温常压下,11.2 L O2含有的分子数为0.5NA
B. 71 g Cl2所含原子数为2NA
C. 标准状况下,22.4 L H2O含有的分子数为NA
D. 25℃、101Kpa时,64g SO2中含有的分子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠在氯气中产生________色的烟,反应的化学方程式为_____________________,生成物氯化钠中的化学键是__________键,该化合物是_________(填“离子”、“共价”)化合物,氯化钠的电子式为_____________。氢气在氯气中燃烧产生______色的火焰,反应的化学方程式为_______,氯化氢分子中的化学键是_______键,该化合物是________(填“离子”、“共价”)化合物,氯化氢分子的电子式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下图分析,下列结论正确的是_____。
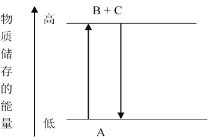
A.A→B+C,B+C→A,两个反应吸收或放出的能量相等
B.A→B+C是放热反应
C.A→B+C是吸热反应
D.A具有的能量高于B+C的能量总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 1 mol羟基中含有l0NA个电子
B. 常温下,22.4 L CH4在O2中完全燃烧,生成NA个CO2分子
C. 标准状况下,18 g H2O中所含的氧原子数为NA
D. 0.2 mol L-1的NH4Cl溶液中含有0.2NA个NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测,月球的土壤中吸附着数百万吨![]() ,100吨
,100吨![]() 核聚变释放的能量相当于目前人类一年消耗的能量。下列说法正确的是
核聚变释放的能量相当于目前人类一年消耗的能量。下列说法正确的是
A. ![]() 的最外层的最外层电子数为2,具有较强的金属性
的最外层的最外层电子数为2,具有较强的金属性
B. ![]() 位于周期表第一周期第ⅡA族
位于周期表第一周期第ⅡA族
C. 每个氦分子中含有的质子数为2、中子数为1
D. 该原子核中质子数为2、中子数为3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com