
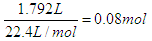 。根据得失电子守恒可知3n(NO)+n(NO2)=2mol,n(NO)+n(NO2)=0.08mol,解得NO的物质的量是0.06mol,NO2是0.02mol,其体积分别为0.06mol×22.4L/mol=1.344L,0.02mol×22.4L/mol=0.448L。
。根据得失电子守恒可知3n(NO)+n(NO2)=2mol,n(NO)+n(NO2)=0.08mol,解得NO的物质的量是0.06mol,NO2是0.02mol,其体积分别为0.06mol×22.4L/mol=1.344L,0.02mol×22.4L/mol=0.448L。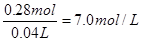 。根据得失电子守恒可知双氧水得到的电子就相当于是铁失去的电子,1mol双氧水得2mol电子,所以需要双氧水得物质的量是0.1mol,其质量是3.4g,因此至
。根据得失电子守恒可知双氧水得到的电子就相当于是铁失去的电子,1mol双氧水得2mol电子,所以需要双氧水得物质的量是0.1mol,其质量是3.4g,因此至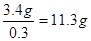 。
。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.海水中溴元素主要以形式Br-存在 | B.上述反应属于离子反应 |
| C.溴单质比氯单质活泼 | D.上述反应属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2HNO3(浓)+Ag ="===" AgNO3+H2O+NO2↑ |
B.2H2SO4 (浓)十C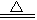 CO2↑+2H2O+2SO2↑ CO2↑+2H2O+2SO2↑ |
| C.H2SO4(稀)+CuO====CuSO4+H2O |
| D.2HNO3(稀)+CaCO3="===Ca" (NO3) 2+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.YO3n-中Y的化合价是+5 | B.n=1() |
| C.Y元素原子的最外层电子数为5 | D.还原性:S2->Y- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaCl2溶液和K2SO4溶液反应 | B.点燃H2和O2的混合气体 |
| C.NaOH溶液和CuSO4溶液反应 | D.Zn放入盐酸中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
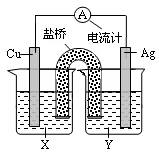
| A.Y为CuSO4溶液 |
| B.正极反应为Cu-2e-= Cu2+ |
| C.在外电路中,电流从Cu极流向Ag极 |
| D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com