


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.③⑤ | C.②④ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是
Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是| A.1 mol摩尔盐强热分解时转移电子的物质的量为8NA |
| B.该反应中氧化产物是N2、NH3,还原产物是SO2、Fe2O3 |
| C.向摩尔盐溶液中滴入足量浓NaOH溶液,最终可得刺激性气体和白色沉淀 |
| D.常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
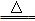 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2K2FeO4+3KNO2+2H2O。下列说法正确的是
2K2FeO4+3KNO2+2H2O。下列说法正确的是| A.该反应是非氧化还原反应 |
| B.KNO3是还原剂 |
| C.生成1mol K2FeO4转移的电子数为4 mol |
| D.K2FeO4不仅具有杀菌消毒作用,而且具有净水作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 PbO2+2Pb(NO3)2+2H2O。铅丹的化学式是 ,此铅丹中铅的化合价是 。由此反应可推测PbO是(填“酸”或“碱”) 性氧化物。
PbO2+2Pb(NO3)2+2H2O。铅丹的化学式是 ,此铅丹中铅的化合价是 。由此反应可推测PbO是(填“酸”或“碱”) 性氧化物。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为1:2 |
| B.SO2气体使品红溶液褪色,表现了SO2的氧化性 |
| C.浓盐酸和MnO2反应时,浓盐酸中的HCl全部被氧化 |
| D.当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该燃料绿色环保,在燃烧过程中不会造成任何环境污染 |
| B.该反应中N2O4是氧化剂,偏二甲肼是还原剂 |
| C.CO2是氧化产物,N2是还原产物 |
| D.每有0.6 mol N2生成,转移电子数目为2.4NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com