
| 选项 | 实验操作及现象 | 实验目的 |
| A | 溶液中滴加盐酸酸化的氯化钡溶液出现白色沉淀 | 检验溶液中存在SO42- |
| B | FeBr2溶液加入少量氯水,溶液有浅绿色变为黄色 | 比较Fe2+、Br-还原性强弱 |
| C | 向一定浓度Na2SiO3溶液中通CO2,溶液变浑浊 | 比较C、Si非金属性强弱 |
| D | 溶液中加KSCN溶液,再加氯水,观察溶液是否出现血红色 | 检验Fe3+溶液中是否含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该沉淀可能为BaSO4或AgCl;
B.向FeBr2溶液中加入少量氯水,溶液由浅绿色变为黄色,说明生成了Fe3+,没有生成Br2;
C.最高价氧化物的水化物的酸性越强,则元素的非金属越强;
D.先加氯水,可氧化亚铁离子,原溶液可能存在铁离子、亚铁离子.
解答 解:A.加入盐酸酸化的氯化钡溶液,有白色沉淀生成,溶液中可能存在Ag+或SO42-,故A错误;
B.向FeBr2溶液中加入少量氯水,溶液由浅绿色变为黄色,说明生成了Fe3+,没有生成Br2,则Fe2+的还原性强于Br-,故B正确;
C.最高价氧化物的水化物的酸性越强,则元素的非金属越强,所以向饱和Na2SiO3溶液中通入二氧化碳,能比较碳与硅的非金属性强弱,故C正确;
D.先加氯水,可氧化亚铁离子,原溶液可能存在铁离子、亚铁离子,则检验亚铁离子应先加KSCN,再加氯水,故D错误.
故选BC.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子的检验、非金属性比较等,把握反应原理、物质的性质及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 48个 | B. | 49个 | C. | 50个 | D. | 51个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 | |
| B. | 若C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4 kJ•mol-1,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 | |
| D. | 若2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 表述I | 表述II |
| A | SiO2有导电性 | SiO2可用于制备光导纤维 |
| B | SO2有漂白性 | SO2可使溴水褪色 |
| C | 溶液中含有大量的NO3- | 溶液中不能存在大量I-或S2- |
| D | 将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5min后取烧杯中液体,加碘水变蓝色 | 半透膜有破损 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al元素的第一电离能比Mg元素的大 | |
| B. | 第2周期元素的最高正化合价都等于其原子的最外层电子数 | |
| C. | 同一周期主族元素从左到右,原子半径和离子半径均逐渐减小 | |
| D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X的简单气态氢化物的热稳定性比W的弱 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| C. | 化合物YX、ZX2、WX3中化学键的类型相同 | |
| D. | 原子半径的大小顺序:Y>Z>W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
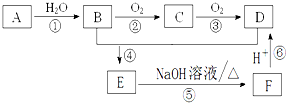 已知:A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平;请回答下列问题:
已知:A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平;请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com