
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 降低温度,溶液中c(NH4+)增大 | |
| C. | 加入少量NaOH固体,平衡向左移动,电离平衡常数减小 | |
| D. | 加入少量0.1 mol•L-1 盐酸,溶液中c(OH-)增大 |
分析 弱电解质的电离是吸热反应,降低温度抑制弱电解质电离,向氨水中加入酸促进一水合氨电离,加入碱抑制一水合氨电离,加水稀释促进一水合氨电离,注意电离平衡常数只与温度有关.
解答 解:A.加水稀释时,促进一水合氨电离,氢氧根 离子的物质的量增大,一水合氨的物质的量减小,所以溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大,故A正确;
B.一水合氨的电离是吸热反应,降低温度抑制其电离,则溶液中c(NH4+)减小,故B错误;
C.向氨水中加入少量氢氧化钠,溶液中氢氧根离子浓度增大,则抑制一水合氨电离,温度不变,电离平衡常数不变,故C错误;
D.向氨水中加入少量盐酸,氢离子和氢氧根离子反应生成水,所以溶液中c(OH-)减小,故D错误;
故选A.
点评 本题考查了弱电解质的电离,明确影响弱电解质电离的因素,题目难度不大,注意加水稀释氨水溶液,溶液中氢离子浓度增大,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定呈碱性 | |
| C. | 某无色溶液中加入BaCl2溶液,再加稀盐酸,沉淀不溶解,原溶液中一定有SO42- | |
| D. | 某无色溶液中加入酚酞试液变红,该溶液一定是碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量NaHCO3与过量Ca(OH)2反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 在CuSO4溶液中加Ba(OH)2溶液 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2S溶液中通入H2S气体 S2-+H+═HS- | |
| D. | NaHCO3溶液与KHSO4溶液反应 HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
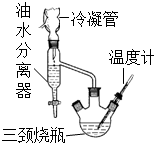 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:| 物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 右 (M+2Q) | B. | 左 (M+2Q) | C. | 右 (M+4Q) | D. | 左 (M+4Q) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水溶解后过滤分离 | B. | 用稀盐酸溶解过滤分离 | ||
| C. | 用稀硫酸溶解过滤分离 | D. | 用酒精灯加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 等体积等物质的量浓度的NaCl和NaClO溶液中离子总数:N前<N后 | |
| C. | 1mol/L的(NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) | |
| D. | 0.1mol/LNaHX溶液pH=3,则此溶液中有:c(HX-)>c(H2X)>c(X2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com