
【题目】如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。

(1)“O”点为什么不导电___________________。
(2)a、b、c三点的氢离子浓度由小到大的顺序为____________。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_________。
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水
E.加固体CH3COONa F.加Zn粒 G.加MgO固体 H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是______________。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
【答案】冰醋酸未电离,无自由移动的离子 c<a<b c ACEFGH BD
【解析】
(1)冰醋酸在O点未能电离,不存在自由移动的离子,因此导电性为0;(2)溶液的导电性越强,溶液中氢离子浓度越大,所以a、b、c三点溶液的c(H+)由小到大的顺序是c<a<b;(3)醋酸是弱酸,存在电离平衡,稀释促进电离。所以a、b、c三点醋酸的电离程度最大的是c点;(4)A.加热促进醋酸电离,则溶液中醋酸根离子浓度增大,故正确;B.加很稀的NaOH溶液,促进醋酸电离,但溶液的体积增大,导致醋酸根离子浓度减小,故错误;C.加KOH固体,氢氧化钾和氢离子反应促进醋酸电离,所以醋酸根离子浓度增大,故正确;D.加水稀释能促进醋酸电离,但醋酸根离子浓度减小,故错误;E.加固体CH3COONa,能抑制醋酸电离,但醋酸钠电离出的醋酸根离子大于抑制醋酸电离出的醋酸根离子,所以醋酸根离子浓度增大,故正确;F.加入锌粒,和氢离子反应,促进醋酸电离,所以醋酸根离子浓度增大,故正确;G.加MgO固体和氢离子反应,促进醋酸电离,所以醋酸根离子浓度增大,故正确;H.加Na2CO3固体,和氢离子反应,促进醋酸电离,所以醋酸根离子浓度增大,故正确;答案选ACEFGH;(5)A.在稀释过程中,溶液的体积增大,氢离子的浓度减小,故A错误;B.弱电解质越稀,电离度越大,即电离出的氢离子数越多,故B正确;C.弱电解质越稀,电离度越大,平衡向右移动,CH3COOH分子数减少,故C错误;D.加水稀释,促进电离,n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,则c(H+)/c(CH3COOH)增大,故D正确;故答案为:BD。


科目:高中化学 来源: 题型:
【题目】常温下,向l L pH=l0的NaOH溶液中持续通入CO2。通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示。下列叙述错误的是
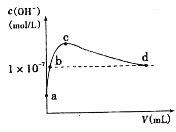
A. a点溶液中:水电离出的c(H+)=1×10-10mol·L-1
B. b点溶液中:c(H+)=1×10-7mol·L-1
C. c点溶液中:c(Na+)>c(HCO3-)>c(CO32-)
D. d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制氢气的一个重要反应是:CO(g)+H2O(g)CO2(g)+H2(g),已知在25℃时:
C(石墨)+ 1/2O2(g)=CO(g) △H=-111kJ/mol
H2(g)+ 1/2O2(g)=H2O(g) △H=-242kJ/mol
C(石墨)+O2(g)=CO2(g) △H=-394kJ/mol
则25℃时,1molCO与水蒸气作用转化为氢气和二氧化碳反应的△H为( )
A. +41kJ/mol B. -41kJ/mol C. -283kJ/mol D. -131kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图所示(所加试剂均过量,气体全部逸出)

下列说法一定正确的是( )
A. 溶液中一定含有Na+,Na+浓度是0.35mol/L
B. 溶液中只有SO42-、CO32-、NH4+离子
C. 溶液中可能含有Cl-,一定没有Fe3+
D. 取原溶液少许加入硝酸酸化的AgNO3溶液检验是否有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是重要的化工原料,用途非常广泛。
实验一:SO2可以抑制细菌滋生,具有防腐功效。某实验小组欲用下图所示装置测定某品牌葡萄酒中(葡萄酒中含有乙醇、有机酸等)的SO2含量。
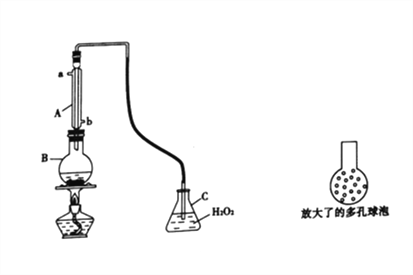
(1)仪器A的名称是________;使用该装置主要目的是____________________。
(2)B中加入 300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,C中化学方程式为_________________________________________。
(3)将输入C装置中的导管顶端改成具有多孔的球泡(如图15所示)。可提高实验的准确度,理由是_______________________________________。
(4)除去C中的H2O 然后用0.099mol·L-1NaOH标准溶液滴定。
①用碱式滴定管量取0.09mol·L-1NaOH标准溶液前的一步操作是___________________________;
②用该方法测定葡萄酒中SO2的含量偏高,主要原因是__________________________________,利用现有的装置,提出改进的措施是_______________________________________________。
(5)利用C中的溶液,有很多实验方案测定葡萄酒中SO2的含量。现有0.1mol·L-1BaCl2溶液,实验器材不限,简述实验步骤:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
(1)化学反应速率本质上是由___________________决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明________对反应速率有影响,该因素对反应速率的具体影响是:其它条件相同时,________________反应速率越快。
(2)我们最好选取实验1、2和4研究锌的形状对反应速率的影响。我们发现在其它条件相同时,反应物间的________________反应速率越快。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是__________________________________________。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:

(5)反应开始至2 min,Y的平均反应速率_____________________。
(6)分析有关数据,写出X、Y、Z的反应方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)1molN2(g)与适量O2(g)起反应生成NO2(g),吸收68 kJ热量。_______________________。
(2)1molCu(s)与适量O2(g)起反应生成CuO(s),放出157 kJ热量。________________________。
(3)卫星发射时可用(N2H4)作燃料,1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622 kJ热量___。
(4)汽油的重要成分是辛烷(C8H18),1molC8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5 518 kJ热量。______________________________。
(5)1molC(s)与适量H2O(g)起反应生成CO(g)和H2(g),吸收131.5kJ热量。_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只能有共价键
C. 由X、Y两种元素形成的化合物都是酸性氧化物
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,草酸溶液中部分微粒的物质的量浓度随NaOH溶液的加入pH 的变化如图所示。其中c (H2C2O4) +c (HC2O4-)+ c (C2O42-)=0.1mol/L,下列说法不正确的是

A. H2C2O4的Ka2数量级为10-5
B. NaHC2O4溶液中,c (Na+)>c(HC2O4-)>c (H+)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度为80%
D. pH=7.0的溶液中,c (Na+)=0.1 + c(C2O42-) - c (H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com