
【题目】工业制氢气的一个重要反应是:CO(g)+H2O(g)CO2(g)+H2(g),已知在25℃时:
C(石墨)+ 1/2O2(g)=CO(g) △H=-111kJ/mol
H2(g)+ 1/2O2(g)=H2O(g) △H=-242kJ/mol
C(石墨)+O2(g)=CO2(g) △H=-394kJ/mol
则25℃时,1molCO与水蒸气作用转化为氢气和二氧化碳反应的△H为( )
A. +41kJ/mol B. -41kJ/mol C. -283kJ/mol D. -131kJ/mol
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】新型夹心层石墨烯锂硫二次电池的工作原理可表示为16Li+xS8![]() 8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是
8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是
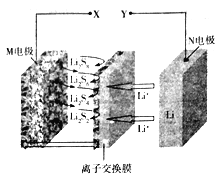
A. 电池充电时X为电源负极
B. 放电时,正极上可发生反应:2Li++Li2S4+2e-=2Li2S2
C. 充电时,没生成1molS8转移0.2mol电子
D. 离子交换膜只能通过阳离子,并防止电子通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列两种转化途径,某些反应条件和产物已省略。下列有关说法不正确的是
途径① S![]() H2SO4
H2SO4
途径② S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①反应中体现了浓硝酸的强氧化性和酸性
B. 途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本
C. 由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D. 途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种日常生活中不可缺少的调味品.已知C可在D中燃烧发出苍白色火焰,M与其他物质的转化关系如图所示(部分产物已略去)

(1)写出用惰性电极电解M溶液的离子方程式_____。
(2)比较B中各元素原子半径由大到小_____(填元素符号)。
(3)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是_____。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_____。
(5)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是_____。
(6)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32﹣、SO42﹣中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为_____。

(7)若E可用于检验葡萄糖的存在,写出G溶液充分蒸发灼烧后的产物与乙醇反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2![]() PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中新社三亚2017年10月8日电,“深海勇士”号载人深潜试验队在中国南海完成“深海勇士”号载人潜水器的全部海上试验任务。Na2O2、KO2都可以作潜水员的供氧剂。

回答下列问题:
(1)KO2中氧元素化合价为_____________。
(2)在过氧化钠与二氧化碳反应中。氧化剂,还原剂的质量之比为________。39g过氧化钠吸收CO2产生氧气体积为_______L(标准状况)。
(3)等物质的量的Na2O2、KO2吸收足量CO2产生O2体积比为_____(同温同压)。
(4)将30g H2、CO的混合气体(平均相对分子质量为15)充入真空密闭容器中,再充入足量氧气,用电火花引燃气体使H2、CO完全反应。将其产物全部通入足量的过氧化钠粉末中、固体质量净增______g,转移电子的个数约为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。

(1)“O”点为什么不导电___________________。
(2)a、b、c三点的氢离子浓度由小到大的顺序为____________。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_________。
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水
E.加固体CH3COONa F.加Zn粒 G.加MgO固体 H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是______________。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象及结论正确的是
A. 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明KSP (AgCl)> KSP (AgI)
B. 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者
C. Na2CO3溶液滴入足量硼酸溶液中,无气泡生成,说明Ka: H2CO3>H3BO3
D. 若弱酸的酸性H2A>H2B>HA->HB-,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者等于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com