
【题目】中新社三亚2017年10月8日电,“深海勇士”号载人深潜试验队在中国南海完成“深海勇士”号载人潜水器的全部海上试验任务。Na2O2、KO2都可以作潜水员的供氧剂。

回答下列问题:
(1)KO2中氧元素化合价为_____________。
(2)在过氧化钠与二氧化碳反应中。氧化剂,还原剂的质量之比为________。39g过氧化钠吸收CO2产生氧气体积为_______L(标准状况)。
(3)等物质的量的Na2O2、KO2吸收足量CO2产生O2体积比为_____(同温同压)。
(4)将30g H2、CO的混合气体(平均相对分子质量为15)充入真空密闭容器中,再充入足量氧气,用电火花引燃气体使H2、CO完全反应。将其产物全部通入足量的过氧化钠粉末中、固体质量净增______g,转移电子的个数约为_________。
【答案】![]() 1:1 5.6L 2:3 30 1.204×1024
1:1 5.6L 2:3 30 1.204×1024
【解析】
(1)化合物中化合价代数和为0,钾元素为+1价,KO2中氧元素化合价为0.5价;(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2,反应中氧化剂与还原剂的物质的量之比为1:1,由方程式,每2molNa2O2参加反应,产生的氧气为1mol,39g过氧化钠的物质的量为![]() =0.5mol,吸收CO2产生氧气体积为
=0.5mol,吸收CO2产生氧气体积为![]() ×22.4L·mol-1=5.6L(标准状况);(3)由2Na2O2+2CO2=2Na2CO3+O2,4KO2+2CO2=2K2O3+3O2可得:等物质的量的Na2O2、KO2吸收足量CO2产生O2体积比为2:3;(4)Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应2CO+O2
×22.4L·mol-1=5.6L(标准状况);(3)由2Na2O2+2CO2=2Na2CO3+O2,4KO2+2CO2=2K2O3+3O2可得:等物质的量的Na2O2、KO2吸收足量CO2产生O2体积比为2:3;(4)Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应2CO+O2![]() 2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2![]() 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,固体质量净增质量就是混合气体的质量30g;平均相对分子质量为15,30g H2、CO的混合气体的物质的时为30g/15g·mol-1=2mol,转移电子2mol×2×6.02×1023=1.204×1024。
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,固体质量净增质量就是混合气体的质量30g;平均相对分子质量为15,30g H2、CO的混合气体的物质的时为30g/15g·mol-1=2mol,转移电子2mol×2×6.02×1023=1.204×1024。


科目:高中化学 来源: 题型:
【题目】在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。

①A点的逆反应速率v逆(O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
A.容器内气体颜色不再变化 | B.v正(NO)="2" v正(O2) |
C.气体平均摩尔质量在此条件下达到最大 | D.容器内气体密度不再变化 |
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g) △H= 。


(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)![]() 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是

A. 0~t2时,v(正)>v(逆)
B. t2时刻改变的条件可能是加催化剂
C. Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ
D. Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制氢气的一个重要反应是:CO(g)+H2O(g)CO2(g)+H2(g),已知在25℃时:
C(石墨)+ 1/2O2(g)=CO(g) △H=-111kJ/mol
H2(g)+ 1/2O2(g)=H2O(g) △H=-242kJ/mol
C(石墨)+O2(g)=CO2(g) △H=-394kJ/mol
则25℃时,1molCO与水蒸气作用转化为氢气和二氧化碳反应的△H为( )
A. +41kJ/mol B. -41kJ/mol C. -283kJ/mol D. -131kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生活、生产中有广泛应用。
(1)Na3AlF6是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上,用HF、Na2CO3和Al(OH)3制备冰晶石。化学反应原理是,2Al(OH)3+3Na2CO3+12H=2Na3AlF6+3CO2↑+9H2O.属于盐的有Na2CO3和_______。上述反应不能在玻璃容器中反应,其原因是________(用化学方程式表示)。
(2)明矾[KAl(SO4)2·12H2O]常作净水剂。在明矾溶液中滴加氢氧化钡溶液至Al3+恰好完全沉淀,写出该反应的离子方程式____________。
(3)铝合金广泛用于建筑材料。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生氢气体积相等(同温同压)。则该合金中铁、硅的质量之比为______。(已知:Si+2NaOH+H2O=Na2SiO3+ 2H2↑)
(4)铝氢化钠(NaAlH4)是有机合成的重要还原剂。它的制备方法是将氢化钠和氯化铝在乙醚中反应制备铝氢化钠。
①写出化学方程式________________。
②在化学上,含氢还原剂的还原能力用“有效氢”表示,”有效氢”含义是单位质量的含氢还原剂的还原能力相当于多少克氢气。一般地含氢还原剂的氢被氧化成H2O,“还原能力”用氢失去电子数多少表示。NaAlH4、NaH的“有效氢”之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图所示(所加试剂均过量,气体全部逸出)

下列说法一定正确的是( )
A. 溶液中一定含有Na+,Na+浓度是0.35mol/L
B. 溶液中只有SO42-、CO32-、NH4+离子
C. 溶液中可能含有Cl-,一定没有Fe3+
D. 取原溶液少许加入硝酸酸化的AgNO3溶液检验是否有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是重要的化工原料,用途非常广泛。
实验一:SO2可以抑制细菌滋生,具有防腐功效。某实验小组欲用下图所示装置测定某品牌葡萄酒中(葡萄酒中含有乙醇、有机酸等)的SO2含量。
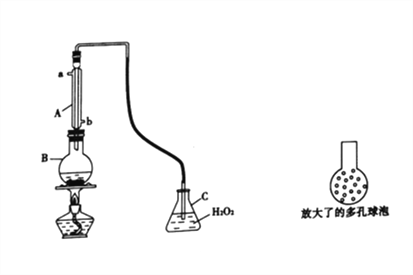
(1)仪器A的名称是________;使用该装置主要目的是____________________。
(2)B中加入 300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,C中化学方程式为_________________________________________。
(3)将输入C装置中的导管顶端改成具有多孔的球泡(如图15所示)。可提高实验的准确度,理由是_______________________________________。
(4)除去C中的H2O 然后用0.099mol·L-1NaOH标准溶液滴定。
①用碱式滴定管量取0.09mol·L-1NaOH标准溶液前的一步操作是___________________________;
②用该方法测定葡萄酒中SO2的含量偏高,主要原因是__________________________________,利用现有的装置,提出改进的措施是_______________________________________________。
(5)利用C中的溶液,有很多实验方案测定葡萄酒中SO2的含量。现有0.1mol·L-1BaCl2溶液,实验器材不限,简述实验步骤:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)1molN2(g)与适量O2(g)起反应生成NO2(g),吸收68 kJ热量。_______________________。
(2)1molCu(s)与适量O2(g)起反应生成CuO(s),放出157 kJ热量。________________________。
(3)卫星发射时可用(N2H4)作燃料,1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622 kJ热量___。
(4)汽油的重要成分是辛烷(C8H18),1molC8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5 518 kJ热量。______________________________。
(5)1molC(s)与适量H2O(g)起反应生成CO(g)和H2(g),吸收131.5kJ热量。_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 该反应的逆反应为吸热反应
B. 平衡常数:KM>KN
C. 生成乙烯的速率:v(N)一定大于v(M)
D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com