
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 该反应的逆反应为吸热反应
B. 平衡常数:KM>KN
C. 生成乙烯的速率:v(N)一定大于v(M)
D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
科目:高中化学 来源: 题型:
【题目】中新社三亚2017年10月8日电,“深海勇士”号载人深潜试验队在中国南海完成“深海勇士”号载人潜水器的全部海上试验任务。Na2O2、KO2都可以作潜水员的供氧剂。

回答下列问题:
(1)KO2中氧元素化合价为_____________。
(2)在过氧化钠与二氧化碳反应中。氧化剂,还原剂的质量之比为________。39g过氧化钠吸收CO2产生氧气体积为_______L(标准状况)。
(3)等物质的量的Na2O2、KO2吸收足量CO2产生O2体积比为_____(同温同压)。
(4)将30g H2、CO的混合气体(平均相对分子质量为15)充入真空密闭容器中,再充入足量氧气,用电火花引燃气体使H2、CO完全反应。将其产物全部通入足量的过氧化钠粉末中、固体质量净增______g,转移电子的个数约为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型抗溃疡药瑞巴匹特,可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:
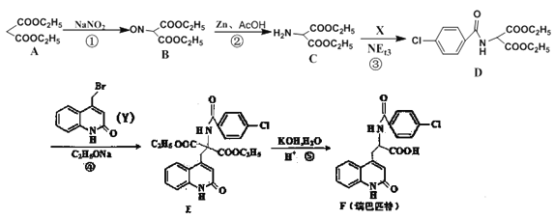
(1)A的化学名称为______________,C的核磁共振氢谱具有_________________组峰
(2)A与足量的NaOH溶液反应的化学方程式为______________
(3)化合物F中含氧官能团的名称为__________________,化合物F的分子式为_____________
(4)反应①~③中,属于取代反应的是__________________(填序号)
(5)C→D的转化中,生成的另一种产物为HCl,则C→D反应的化学方程式为__________
(6)已知Y中的溴原子被--OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:___________________
I.分子中含有一个苯环和一个五元环,且都是碳原子环
II.苯环上有两个取代基,且处于对位
III.能与NaHCO3溶液发生反应
(7)已知CH3CH2OH![]() CH3CH2Br,以A和HOCH2CH2CH2OH为原料制备
CH3CH2Br,以A和HOCH2CH2CH2OH为原料制备![]() 的合成路线流程图如下:HOCH2CH2CH2OH
的合成路线流程图如下:HOCH2CH2CH2OH![]() 物质X
物质X![]() 物质Y
物质Y![]()
![]() ,则物质X为__________,物质Y为____________
,则物质X为__________,物质Y为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象及结论正确的是
A. 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明KSP (AgCl)> KSP (AgI)
B. 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者
C. Na2CO3溶液滴入足量硼酸溶液中,无气泡生成,说明Ka: H2CO3>H3BO3
D. 若弱酸的酸性H2A>H2B>HA->HB-,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者等于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是( )
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是( )

A. 脱氢反应的△H<0
B. 在t1K时,该反应的平衡常数为8.1
C. 600K时,Y点甲醇的υ(正) <υ(逆)
D. 若增大体系压强,曲线将向上平移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产和生命活动中起着重要作用。
(1)氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
哈伯法合成氨技术的相关反应为:N2(g)+3H2(g)![]() 2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①合成氨技术是氮的固定的一种,属于______(选填“大气固氮”、“生物固氮”“人工固氮”)。
②合成氨反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是_________。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
③关于合成氨工艺的下列理解,正确的是_________。
A.原料气中N2过量,是因N2相对易得,适度过量有利于提高H2的转化率
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(2)肼(N2H4)是氮的氢化物之一,其制备方法可用次氯酸钠氧化过量的氨气。
①次氯酸钠溶液显碱性,表示原理的离子方程式是_________________________。
②常温下,该水解反应的平衡常数为K=1.0×10-6mol/L,则1.0mol/LNaClO溶液的pH=____。
③肼与N2O4氧化反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ/mol
请写出肼和N2O4反应的热化学反应方程式_________________________________。
(3)在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+ 3B(g)![]() 2C(g) + 2D(g)在四种不同情况下的反应速率分别为①v(A)= 0.15 mol/(L·s)②v(B)=0.6 mol/(L·s) ③v(C)=0.5 mol/(L·s)④v(D)=0.45 mol/(L·s)。下列表示该反应进行由快到慢的顺序正确的是( )
2C(g) + 2D(g)在四种不同情况下的反应速率分别为①v(A)= 0.15 mol/(L·s)②v(B)=0.6 mol/(L·s) ③v(C)=0.5 mol/(L·s)④v(D)=0.45 mol/(L·s)。下列表示该反应进行由快到慢的顺序正确的是( )
A.②③④①B.④③②①C.③④②①D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的短周期主族元素X、Y、Z、W、R,其中X、Y两种元素的核电荷数之差等于它们的原子最外层电子数之和;Y、Z位于相邻主族;Z是地壳中含量最高的元素。X、W是同主族元素。上述五种元素两两间能形成四种常见的化合物甲、乙、丙、丁,这四种化合物中原子个数比如下表:

(1)写出下列元素符号:Y________Z ________W ________R __________
(2)写出下列化合物的电子式:乙__________ 丙____________
(3)向甲的水溶液中加入丁,有淡黄色沉淀生成,请写出反应的化学方程式:_____________________
(4)甲和乙反应能放出大量的热,同时生成两种无污染的物质,请写出该反应的化学方程式:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构简式为:______________
(2)写出B、D化合物中官能团名称:
B中含官能团_____________;D中含官能团_________;
(3)写出反应的化学方程式
①___________________________________________ 反应类型:___________
②___________________________________________ 反应类型:___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com