
【题目】铜与浓硝酸反应的方程式为:![]()
(1)在该反应中,被还原的元素是_______,氧化产物是_______。
(2)在方程式标出电子转移的方向和数目_______。
(3)若有32g铜参与反应,被还原的硝酸有_______mol。
【答案】HNO3中+5价的氮 硝酸铜 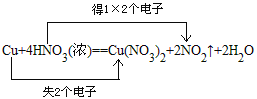 1
1
【解析】
由化学方程式可知,反应中,铜单质中铜元素化合价升高被氧化,铜做还原剂,硝酸铜为氧化产物,浓硝酸中氮元素化合价降低被还原,浓硝酸做氧化剂,二氧化氮为还原产物。
(1)在该反应中,铜单质中铜元素化合价升高被氧化,铜做还原剂,硝酸铜为氧化产物,浓硝酸中+5价的N的化合价降低被还原,浓硝酸做氧化剂;
(2)在该反应中,铜做还原剂,浓硝酸做氧化剂,电子转移的数目为2e-,则电子转移的方向和数目为 ;
;
(3)由化学方程式可知,1mol铜参加反应有2mol硝酸被还原,32g铜的物质的量为![]() =0.5mol,则被还原的硝酸的物质的量为0.5mol×2=1mol。
=0.5mol,则被还原的硝酸的物质的量为0.5mol×2=1mol。


科目:高中化学 来源: 题型:
【题目】全钒液流电池充电时间短,续航能力强,被誉为“完美电池”,工作原理如图1所示,反应的离子方程式为:VO2++V3++H2O![]() VO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可再生NaOH,同时得到H2SO4,其原理如图2所示。下列说法正确的是
VO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可再生NaOH,同时得到H2SO4,其原理如图2所示。下列说法正确的是

A. 电解Na2SO3溶液时,a极与电池负极相连,图1中H+从电池右边移向左边
B. 电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+
C. 电池放电时,负极的电极反应式为VO2++e-+2H+=VO2++H2O
D. 若电解过程中图2所有液体进出口密闭,则消耗12.6gNa2SO3阴极区变化的质量为4.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池是人类生产和生活中的重要能量来源,下列有关电池的叙述正确的是( )
A. 锌锰干电池工作一段时间后碳棒变细
B. 铅蓄电池放电时铅在负极被氧化成二氧化铅
C. 太阳能电池的主要材料是高纯度的二氧化硅
D. 氢氧燃料电池产物为水,属于环境友好电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。
已知:①NaNH2+N2O![]() NaN3+H2O。
NaN3+H2O。
②NaNH2能与水反应生成NaOH和NH3
实验室利用如下装置模拟工业级NaN3的制备。

请回答下列问题:
实验I:制备NaN3
(1)装置C中盛放的药品为______________________;
(2)为了使反应均匀受热,装置D处b容器应采取的加热方式为______________________。
(3)实验开始时首先应加热通氨气,其目的是___________。
(4)氨气与熔化的钠反应生成NaNH2的化学方程式为___________。
实验Ⅱ:分离提纯
反应完全结束后,取出装置D中的混合物进行以下操作,得到NaN3固体。

(5)操作ⅳ采用乙醚洗涤的原因是______________________(答一项即可)。
实验Ⅲ:定量测定
实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500mL溶液
②取50.00L溶液置于锥形瓶中,加入50.00mL0.1010m1·L-1(NH4)2Ce(NO3)6溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8.00mL浓硫酸,滴人3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑, Ce4++Fe2+=Ce3++Fe3+。
(6)配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有______________________。
(7)若其它读数正确,滴定到终点后,读取滴定管中(NH4)2Fe(SO4)2标准溶液体积时俯视,将导致所测定样品中叠氮化钠质量分数___________(选填“偏大”、“偏小”或“不变”)。
(8)减样中NaN3的质量分数为___________ (保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简单原子的原子结构可用图形象地表示:其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是( )

A.①②③互为同素异形体
B.①②③互为同分异构体
C.①②③是三种化学性质几乎相同的不同粒子
D.①②③具有相同的质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子有三个电子层,最外层上有一个电子;B元素负2价阴离子的电子层结构与氩原子相同;C元素的原子核内无中子;D原子核外电子数比A原子核外电子总数多6个。
(1)C与D形成化合物的化学式_______,其在水中的电离方程式为_______。
(2)B离子的电子式_______,A离子的电子式_______。
(3)B原子的结构示意图_______,D离子的结构示意图_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com