


科目:高中化学 来源: 题型:
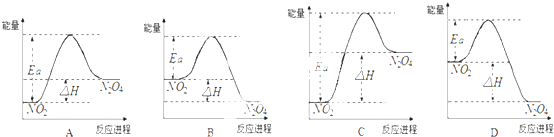
查看答案和解析>>
科目:高中化学 来源: 题型:
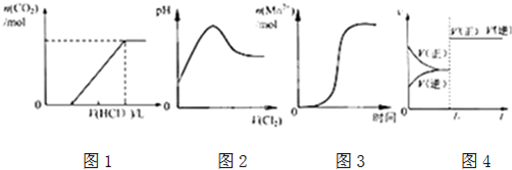
| A、图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
| B、图2表示Cl2通入H2S溶液中pH的变化 |
| C、图3表示10 mL 0.01 mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) |
| D、图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经过气化和液化等物理变化可以转化为清洁燃料 |
| B、在海轮外壳上镶入锡块,可减缓船体的腐蚀速率 |
| C、光化学烟雾的形成与汽车尾气中的氮氧化物有关 |
| D、“鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
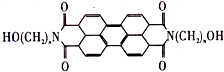 变色龙的外表随环境变化时一种生物的适应性,保护色在军事上用于进行“地表伪装”一直备受战争专家的青睐,BAFS是最近开发的芘系新型红外伪装还原染料,该染料为橄榄色或黑色,其化学结构如图,当n=3时,其一氯代物(不考虑醇羟基被取代)可能有( )
变色龙的外表随环境变化时一种生物的适应性,保护色在军事上用于进行“地表伪装”一直备受战争专家的青睐,BAFS是最近开发的芘系新型红外伪装还原染料,该染料为橄榄色或黑色,其化学结构如图,当n=3时,其一氯代物(不考虑醇羟基被取代)可能有( )| A、3种 | B、5种 | C、6种 | D、7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NH4+、NO3-、MnO4- |
| B、K +、SO42-、OH-、CO32- |
| C、K +、Fe3+、Cl-、Br- |
| D、Ba2+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白 红 白 |
| B、红 黑 红 |
| C、红 红 红 |
| D、白 黑 白 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com