
【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。
【答案】4Na2SO3![]() Na2S+3Na2SO4 0.75NA > 水存在电离平衡:H2O
Na2S+3Na2SO4 0.75NA > 水存在电离平衡:H2O![]() H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动。 Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4 取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动。 Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4 取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
【解析】
(1)Na2SO3固体隔绝空气加强热,硫元素发生歧化反应,据此写出方程式,并根据反应6e-~4Na2SO3关系,计算0.5molNa2SO3参加反应,电子转移个数;
(2)能水解的盐促进水的电离;亚硫酸钠具有还原性,能够被氧气氧化为硫酸钠,硫酸钠不水解,显中性,据此进行分析;根据硫酸根离子的检验方法判断亚硫酸钠中是否含有硫酸钠;
(3) Na2SO3溶液中存在水解平衡:SO32-+H2O ![]() HSO3- +OH- ,HSO3- + H2O
HSO3- +OH- ,HSO3- + H2O ![]() H2SO3 +OH- ,据此分析离子浓度大小顺序。
H2SO3 +OH- ,据此分析离子浓度大小顺序。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-,说明部分硫元素发生还原反应生成S2-,还有部分硫元素发生氧化反应生成SO42-,因此反应的化学方程式为4Na2SO3![]() Na2S+3Na2SO4;该反应转移电子为6e-;根据6e-~4Na2SO3关系可知,若有0.5molNa2SO3参加反应,则电子转移个数为0.75 NA;
Na2S+3Na2SO4;该反应转移电子为6e-;根据6e-~4Na2SO3关系可知,若有0.5molNa2SO3参加反应,则电子转移个数为0.75 NA;
综上所述,本题答案是:4Na2SO3![]() Na2S+3Na2SO4 ; 0.75NA。
Na2S+3Na2SO4 ; 0.75NA。
(2) 水存在电离平衡:H2O![]() H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动。促进了水的电离,所以Na2SO3溶液中水的电离程度大于同温下纯水中水的电离程度;亚硫酸钠的还原性比较强,随着温度的变化,或有Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4,所以④的pH略小于①;要证明此实验事实的存在,就是要证明溶液中是否含有硫酸离子,可以用过量的盐酸和氯化钡溶液进行检验,具体操作如下:取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 ;
H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动。促进了水的电离,所以Na2SO3溶液中水的电离程度大于同温下纯水中水的电离程度;亚硫酸钠的还原性比较强,随着温度的变化,或有Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4,所以④的pH略小于①;要证明此实验事实的存在,就是要证明溶液中是否含有硫酸离子,可以用过量的盐酸和氯化钡溶液进行检验,具体操作如下:取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 ;
综上所述,本题答案是:>;水存在电离平衡:H2O![]() H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动;Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4 ; 取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 。
H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动;Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4 ; 取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 。
(3) Na2SO3溶液中存在水解平:SO32-+H2O ![]() HSO3- +OH- ,HSO3- + H2O
HSO3- +OH- ,HSO3- + H2O ![]() H2SO3 +OH- ,溶液显碱性,从水解的规律可知Na2SO3溶液中所有离子浓度由大到小排列:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
H2SO3 +OH- ,溶液显碱性,从水解的规律可知Na2SO3溶液中所有离子浓度由大到小排列:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
综上所述,本题答案是:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关分散系的叙述中不正确的是( )
A.胶体分散质微粒直径较大,不能透过滤纸
B.液态分散系根据分散质粒子大小分为溶液、胶体和浊液三类
C.利用丁达尔效应可以区分溶液和胶体
D.纳米材料分散到液体分散剂中得到的分散系属于胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福韦酯(TDF)主要用于治疗艾滋病毒(HIV)感染,化合物W是合成TDF的重要中间体,其合成路线如图所示。
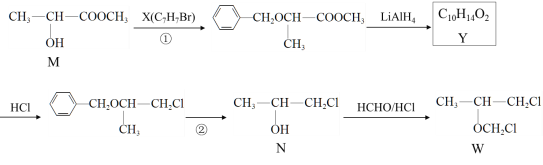
完成下列填空:
(1)N所含官能团的名称是______________;Y的结构简式是____________________。
(2)X可用苯的一种同系物制备,所需的无机试剂与条件是____________________。
(3)写出检验W中是否有残留甲醛的化学方程式____________________________________。
(4)①②的目的是_______________________。
(5)写出M符合下列条件的一种同分异构体的结构简式。_______________
i. 与M具有相同官能团 ii. 能发生银镜反应
(6)写出用M为原料制备聚丙烯酸( )的合成路线_______________________ 。
)的合成路线_______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲用下列装置制备氯水并探究其性质。
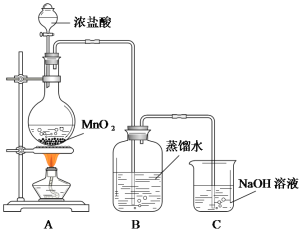
已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)C装置的作用是__________________________________。
(2)氯水制备完成后,甲同学从B中取出一定量的样品置于日光下照射一段时间,发现样品某些性质发生了明显的变化,请各列举一项:
物理性质变化:______________________________________________________;
化学性质变化:_______________________________________________________。
(3)乙同学从B中取出一定量的样品后通入SO2,充分作用后再滴入少量品红溶液,发现品红溶液不褪色。原因是__________________________________(用离子方程式表示)。丙同学改变通入SO2的量,重复乙同学的操作,发现品红溶液红色褪去。他提出:假设①:SO2过量,多余的SO2使品红溶液褪色;假设②:_________________________。请设计实验验证假设①是否成立:______________________。
(4)为证明氯气与水反应产物具有漂白性,丁同学将A中产生的气体缓缓通过下列装置:

试剂a应选择_______________;试剂b应选择_______________。
(5)戊同学从B中取出少量样品,滴到NaHCO3粉末上,有无色气泡产生,由此他认为氯气与水反应至少产生一种酸性强于碳酸的物质。请评价他的观点是否正确并说明理由________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是我国规定的食盐补碘剂,利用“KClO3氧化法”可制备KIO3,流程如下:
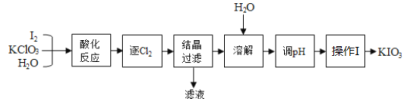
已知:“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。
(1)KIO3所含的化学键有______________________。
(2)逐出的Cl2可用_________________检验;“滤液”中的溶质主要是____________;“调pH”中所用的试剂是_________________。
(3)已知KIO3在水中的溶解度随温度升高而增大,则操作I包含的操作应该是_______、_______、过滤。
(4)为测定“加碘食盐”中碘元素含量:①称取50.000g食盐,配成250mL溶液;②量取25.00mL溶液于锥形瓶中,加入足量KI,并用少量稀硫酸酸化,使KIO3与KI反应完全;③以淀粉为指示剂,用2.0×10-4mol/L的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液体积为30.00mL。已知:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),2Na2S2O3+I2→Na2S4O6+2NaI。测定过程中,所需仪器在使用前必须检查是否漏液的有________________。
(5)判断滴定终点的依据是________________________________。
(6)配平:KIO3+KI+H2SO4→K2SO4+I2+H2O ____________
(7)该食盐中碘元素的含量是_________mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,CO和CH4燃烧的热化学方程式为:CO(g)+1/2O2=CO2(g);△H=-283KJ/mol
CH4(g)+2O2=CO2(g)+2H2O(g);△H=-890KJ/mol,现有4mol CO和CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为2953KJ,则CO和CH4的体积比
A. 1:3 B. 3:1 C. 1:2 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请应用化学反应原理的相关知识解决下列问题
(1)已知NaCl的溶解热为3.8kJ·mol-1(吸热)
Na(s)-e-====Na+(aq) △H=-240 kJ/mol
![]() Cl2(g)+e-====Cl-(aq) △H=-167 kJ/mol
Cl2(g)+e-====Cl-(aq) △H=-167 kJ/mol
写出钠在氯气中燃烧的热化学方程式_______________________。
(2)一定条件下,在2L恒容密闭容器中充入1.5 mol CO2和3molH2发生反应:CO2(g)+3H2(g) ![]() CH3OH(g) +H3O(g)
CH3OH(g) +H3O(g)
下图是反应体系中CO2的平衡转化率与温度的关系曲线。已知在温度为500K的条件下,该反应l0min达到平衡;
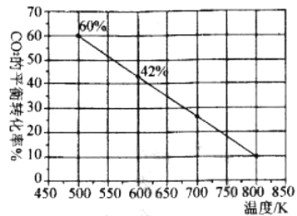
①该反应是__________ (填“吸热”或“放热”)反应。
②在0~10min时段反应速率v(H2)为__________。
③若改充入2 mol CO2和3molH2,图中的曲线会__________(填“上移”或“下移”)。
(3)根据下表数据回答问题:
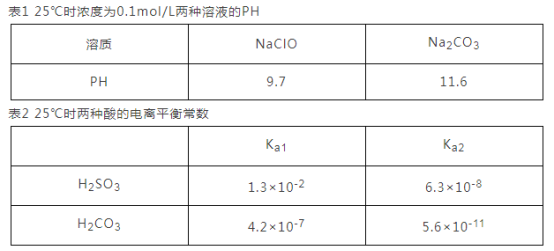
①根据表1能不能判断出H2CO3与HClO酸性强弱? _________(填“能”或“不能”)。
②0.10mol·L-lNa2SO3溶液中离子浓度由大到小的顺序为___________________________。
③H2SO3溶液和 NaHCO3溶液反应的离子方程式为________________________________。
(4)已知:t℃时,Ksp(AgCl)=1.5×10-10、Ksp (Ag2CrO4)=2.0×10-12;AgCl为白色沉淀,Ag2CrO4为砖红色沉淀,t℃时,向Cl-和CrO42-浓度均为0.1mol/L的混合溶液中逐滴加入AgNO3溶液至过量且不断搅拌,实验现象为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、H、O三种元素在人体内质量分数约为73%左右,而在组成岩石圈的化学成分中还不到1%,这一事实说明了( )
A. 生物界与非生物界具有相似性
B. 生物界与非生物界的元素组成是不同的
C. 生物界与非生物界具有统一性
D. 生物界与非生物界存在差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯及芳香烃的认识是一个不断深化的过程。
(1)已知分子式为C6H6的烃结构有多种,其中的两种为![]()
①下列反应中Ⅰ能________(填字母)而Ⅱ不能。
a.被酸性高锰酸钾溶液氧化 b.与溴水发生加成反应
c.与液溴发生取代反应 d.在空气中可以燃烧
②1 mol 物质与H2加成时, Ⅰ 需H2________mol,而 Ⅱ 需H2________mol。
③Ⅰ的一氯取代产物有_______种,Ⅱ的二氯取代产物有______种
![]()
(2)今发现C6H6还可能有另一种立体结构(如图所示),该结构的二氯代物有____________种。
(3)下列四种芳香烃中,属于苯的同系物的是______
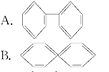
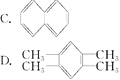
(4)现代化学认为苯分子中碳碳之间的键是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com