
【题目】A、B、C、D、E、F六种短周期元索,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
化合物 | 甲 | 乙 | 丙 | 丁 |
化学式 | A2C | A2C2 | D2C2 | D2E |
回答下列问题:
(1)指出元素F在周期表中的位置___________。
(2)化合物丙的电子式为__________,用电子式表示形成化合物丁的过程_______。
(3) 向丁的溶液中加入硫酸酸化的乙溶液,写出相应的离子方程式:_______。
(4)固体氧化物燃料电池是以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许02-在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体。该电池的正极为______ (填a或b);02-流向______极(填“正”或“负”);该电池的负极反应为 _________ 。

【答案】 第三周期第ⅦA族 ![]()
![]() S2-+2H++H2O2=S↓+2 H2O a 负 H2 —2e-+O2-=H2O
S2-+2H++H2O2=S↓+2 H2O a 负 H2 —2e-+O2-=H2O
【解析】原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多2,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A是周期表中半径最小的元素,则A为H元素;C的最外层电子数是内层电子的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;C与E同主族,则E为S元素;A与D同主族,D的原子序数大于氧,故D为Na;F的原子序数最大,且F元素是同周期元素中原子半径最小的主族元素,故F为Cl.可推知甲为H2O、乙为H2O2、丙为Na2O2、丁为Na2S,(1)元素F为Cl,在周期表中的位置:第三周期第ⅦA族;(2)丙为Na2O2,电子式为![]() ,用电子式表示形成化合物Na2S的过程:
,用电子式表示形成化合物Na2S的过程:![]() ;(3)丁与乙反应的离子方程式为:S2-+2H++H2O2=S↓+2 H2O ;(4)固体氧化物燃料电池是以固体氧化锆﹣氧化钇为电解质,这种固体电解质在高温下允许O2﹣在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体O2、H2的载体,负极发生氧化反应,氢气在负极失去电子,该电池的正极为a,O2﹣流向负极,负极发生氧化反应,氢气在负极失去电子与O2﹣生成水,该电池的负极反应式为:H2 —2e-+O2-=H2O。
;(3)丁与乙反应的离子方程式为:S2-+2H++H2O2=S↓+2 H2O ;(4)固体氧化物燃料电池是以固体氧化锆﹣氧化钇为电解质,这种固体电解质在高温下允许O2﹣在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体O2、H2的载体,负极发生氧化反应,氢气在负极失去电子,该电池的正极为a,O2﹣流向负极,负极发生氧化反应,氢气在负极失去电子与O2﹣生成水,该电池的负极反应式为:H2 —2e-+O2-=H2O。


科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E原子序数依次增大 ,A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为_______。W的电子式_________。
(2)在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)![]() X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
平衡时n(X) | 0.5 mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 |
|
|
|
① 计算该温度下此反应的平衡常数K =_________________。
②三个容器中的反应分别达平衡时下列各组数据关系正确的是___________(填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
(3)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
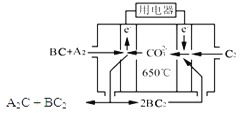
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
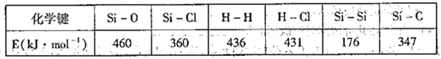
工业上高纯硅可通过下列反制取:SiCl4(g) +2H2(g)= Si(g) +4HCl(g),(已知 lmol晶体Si中2molSi -Si键),该反应产生的热量为
A. 吸收45kJ mo1-1 B. 放出412 kJ mo1-1
C. 吸收 236 kJ mo1-1 D. 放出236 kJ mo1-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品,有广泛用途,工业上可以由氢气和氮气合成。
(1)已知键能:N![]() N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
①氮气、氢气合成氨的热化学方程式是______________。
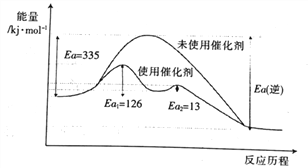
②未使用催化剂时,逆反应的活化能Ea(逆)=______ kJ·mol-1;使用催化剂之后正反应的总活化能为_______ kJ·mol-1。
(2)下表是当反应器中按n(N2):n(H2)=l:3投料后,在200℃、400℃、600℃,反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
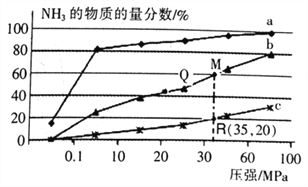
①曲线a、b对应温度较高的是________ (填“a”或“b”)
②实验室模拟工业合成氨,一定温度和压强下在1L密闭容器中通入5 mol N2、15molH2,10min 后达到M点平衡状态,计算从反应开始至平衡时间段内的平均速率V(N2)___mol·L-1·min-1。
③关于工业合成氨的反应,下列叙述正确的是_______(填字母)。
A.分离出NH3后的原料气循环利用,可以提高H2的平衡转化率
B.使州催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、Q、R点平衡常数K的大小关系是K(M)= K(Q)> K(R)
④列出R点平衡常数的计算式Kp=____(MPa)-2。(用平衡分压代替平衡浓度计箅,分压=总压×物质的量分数。不要求计算结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学科学家将古老的养蚕技术与碳纳米管和石墨烯结合,获得了更加牢固的蚕丝纤维,其延展性、抗拉强度显著提高,通过高温加热碳化还可显著提高导电性。下列有关说法正确的是
A. 石墨烯具有良好的导电性能,所以石墨烯基锂电池具有独特优势
B. 蚕丝纤维属于纯净物
C. 石墨烯属于烯烃
D. 蚕丝纤维加热碳化后具有导电性是因为所有碳单质都具有良好的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。

回答下列问题:
(1)操作A是 ______________(填实验基本操作名称)。
(2)操作B需加入下列试剂中的一种,最合适的是_________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)工业上制取金属镁时是电解熔MgCl2电解反应方程式为_________。
(4)上图中虚线框内流程的主要作用是____________。写出溴水中通入S02时反应的离子方程式___________。
(5)上图中虚线框内流程也可用![]() 替代,请写出Br2与Na203反应(其中一种产物为NaBr03)的化学方程式__________。
替代,请写出Br2与Na203反应(其中一种产物为NaBr03)的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25 g/L;B与C在浓琉酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):

(1)A的电子式为__________,C中官能团的名称为 ____________。
(2) 丙烯酸(CH2 =CH -C00H)的性质可能有__________。
a.加成反应 b.取代反应 c.加聚反应 d.中和反应 c.氧化反应
(3)用两种方法鉴别B和C,所用试剂分别 ______、________。
(4)丙烯酸乙酯的结构简式为______________。
(5)写出下列反应方程式:
①___________________________。
③___________________________。
⑤___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:____________,某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是____________。
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+____________,BF3____________。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应方程式____________、_________。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为____________;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com