
【题目】下列反应的离子方程式书写不正确的是
A. 钠与水反应:2Na+2H2O=2Na+ + 2OH- +H2↑
B. 电解饱和食盐水获取碱和氯气:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. 向碳酸氢铵溶液中加入过量石灰水:Ca2+ +HCO3- +OH-=CaCO3 ↓+H2O
D. 向氢氧化钡溶液中加入稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①需要加热方能发生的反应一定是吸热反应
②化学反应的发生一定会伴随能量变化
③反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
④旧化学键的断裂说明-一定发生了化学反应
A. ③④ B. ①② C. ②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S)
B. 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+)
C. 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol/L:c(Na+) = c(CH3COOH) > c(CH3COO-) > c(H+) = c(OH-)
D. 常温下,将0.1 mol/L CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中![]() 的值减小到原来的
的值减小到原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. ![]() C表示质子数为6、中子数为8的核素
C表示质子数为6、中子数为8的核素
B. 甲醇(CH3OH)和甘油(CH2OHCHOHCH2OH)互为同系物
C. C5H12的同分异构体有3种,其沸点各不相同
D. CH3CH2CH2CH(CH3)2的名称是2甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学探究小组同学为探究乙酸乙酯的制备与水解情况,甲、乙同学分别使用图1、图2装置制备乙酸乙酯。

已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。②相关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77 |
(1)甲同学在制得乙酸乙酯后,分离乙酸乙酯与饱和碳酸钠溶液的操作是_______________。
(2)试管中装有饱和Na2CO3溶液,其作用是________(填序号)。
A.吸收乙醇 B.除去乙酸
C.乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)甲同学分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出______________;再加入____________(填序号);然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,乙同学利用图2所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管B,再测有机层的厚度,实验记录如下:

①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol·L-1。
②分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种有机物的说法正确的是
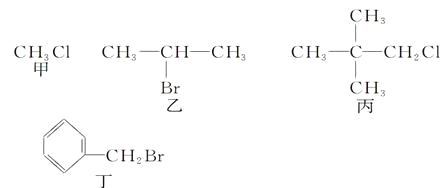
A. 甲、乙、丙、丁中分别加入氯水,均有红棕色液体生成
B. 甲、乙、丙、丁中加入NaOH溶液共热,然后加入稀硝酸调至溶液呈酸性,再滴入AgNO3溶液,均有沉淀生成
C. 甲、乙、丙、丁中加入NaOH的醇溶液共热,然后加入稀硝酸调至溶液呈酸性,再滴入AgNO3溶液,均有沉淀生成
D. 乙发生消去反应得到两种烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
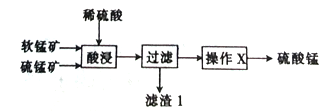
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒半径大小比较中,不正确的是( )
A. r(K)>r(Na)>r(Li) B. r(Mg2+)>r(Na+)>r(F-)
C. r( Na+)>r(Mg2+)>r(Al3+) D. r(Cl-)>r(F-)>r(F)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com