
【题目】根据下列实验内容得出的结论正确的是
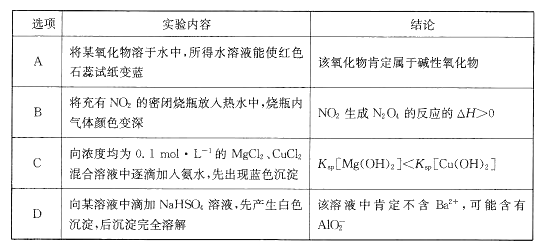
A. A B. B C. C D. D
【答案】D
【解析】
A、水溶液能使红色石蕊试纸变蓝,该溶液为碱性,该氧化物可能为Na2O2,Na2O2不是碱性氧化物,故A错误;
B、发生2NO2![]() N2O4,NO2是红棕色气体,N2O4为无色气体,放入热水中,颜色加深,平衡向逆反应方向进行,即正反应方向为放热反应,△H<0,故B错误;
N2O4,NO2是红棕色气体,N2O4为无色气体,放入热水中,颜色加深,平衡向逆反应方向进行,即正反应方向为放热反应,△H<0,故B错误;
C、加入氨水,出现蓝色沉淀,先生成Cu(OH)2,说明Cu(OH)2比Mg(OH)2更难溶,推出Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
D、因为沉淀完全溶解,即原溶液中不含Ba2+,如果为AlO2-,则发生AlO2-+H++H2O=Al(OH)3↓,继续滴加,发生Al(OH)3+3H+=Al3++3H2O,符合实验现象,原溶液中可能含有AlO2-,故D正确;


科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x 值,进行如下实验:
①称取wg草酸晶体,配成100.00 mL水溶液。
②量取25.00 mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。
③用浓度为a mol/L的KMnO4溶液滴定到终点。
所发生的反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O 。试回答:
(1)实验中不需要的仪器有___________(填序号),还缺少的玻璃仪器有________(填名称)。
a.托盘天平(带砝码,镊子) b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在_____________式滴定管中。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会____________(填“偏大”、“ 偏小”、“ 无影响”)
(4)滴定时,根据_______________现象,即可确定反应达到终点。
(5)在滴定过程中若用amol/L的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_______mol/L,由此可计算x的值是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为欲制的产物,即原子利用率为100%。下列反应最符合绿色化学中“原子经济”要求的是
A. nCH2=CH2![]()
![]()
B. CH4+2Cl2![]() CH2Cl2+2HCl
CH2Cl2+2HCl
C. Cl2+2NaOH===NaCl+NaClO+H2O
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:

(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是______________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是________。
(3)实验中加热试管a的目的是:①______________;②______________。
(4)试管b中加有饱和Na2CO3溶液,其作用是________________。
(5)反应结束后,振荡试管b,静置。观察到的现象是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分。
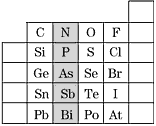
(1)上图中元素N在元素周期表中的位置为_________________,根据元素周期律,请预测H3AsO4、H3PO4的酸性强弱:H3AsO4________H3PO4(填“强于”或“弱于”)。
(2)上图中元素O、S、Se的氢化物的沸点由高到低为:________>________>________。(用化学式填写)_____________
(3)写出S2-的离子结构示意图为______________;判断表中Bi和Te两种元素的金属性强弱:Bi________Te(填“<”或“>”或“=”)。
(4)Br2具有较强的氧化性,SO2具有较强的还原性,请写出将SO2气体通入溴水中反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,AgX(X=CI、Br)的溶度积与c(Ag+)和c(X-)的相互关系如图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是

A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. AgCl(s)+Br-(aq) →AgBr(s)+CI(aq)平衡常数K=10-4
D. a点AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素是一种重要的氮肥,它的合成主要发生以下2步反应:
反应1:2NH3(g)+CO2(g) ![]() NH4COONH2(1) △H1=a kJ·mol-1
NH4COONH2(1) △H1=a kJ·mol-1
反应2:NH4COONH2(1)=====NH2CONH2(1)+H2O(1) △H2=b kJ·mol-1
回答下列问题:
(1)写出合成尿素的热化学方程式:_____________________(用含a、b的代数式表示)。写出一种可以提高NH3平衡转化率的措施:_______________________________。
(2)95℃时,在2L恒容密闭容器中加入3mol氨气和1molCO2使之充分反应合成尿素,达到平衡时,CO2的转化率为60%,则此温度下合成尿素的平衡常数是________________(保留2位小数)。
(3)下表为反应1和反应2在不同温度下达到平衡时所测得的平衡常数(K)的数据。

①从上表数据可推出b_____(填“>”或“<”)0,理由是______________________。
②升高温度,反应1的反应速率将_________(填“增大”或“减小”)。
③下图是合成尿素时温度对二氧化碳转化率的影响曲线。从图中可知A、B、C三点对应的温度下该反应的平衡常数大小关系是_________________(用KA、KB、KC表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取O2和Cl2的化学反应方程式分别为①2KClO3 ![]() 2KCl+3O2↑;②MnO2+4HCl(浓)
2KCl+3O2↑;②MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,则下列说法正确的是( )
MnCl2+Cl2↑+2H2O,则下列说法正确的是( )
A. 均为氧化还原反应
B. ②中MnO2为还原剂
C. ①中反应前后MnO2质量不发生变化
D. ①中反应前后MnO2化学性质改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将w1(g)光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝,用蒸馏水洗涤,干燥,称其质量为w2(g),实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系不正确的是
A. CO w1= w2 B. 石灰水 wl< w2
C. 乙醇溶液 w1<w2 D. NaHSO4溶液 w1>w2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com