
| A、2 | B、3 | C、4 | D、5 |
|


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
| A、因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B、常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C、在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D、加热0.1mol?L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
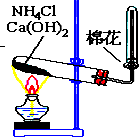 如图所示,是实验室制备某常见气体的实验装置,请填空:
如图所示,是实验室制备某常见气体的实验装置,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离常数(25℃) |
| HF | Ki=3.6×10 -4 |
H3PO4 | Ki1=7.5×10 -3 Ki2=6.2×10 -8 Ki3=2.2×10 -13 |
| A、NaF和H3PO4反应的产物只有HF、NaH2PO4 |
| B、0.10 mol/L的溶液,pH由大到小的顺序是Na3PO4>Na2HPO4>NaF>NaH2PO4 |
| C、0.10 mol/L的H3PO4溶液中,0.30 mol/L>c(H+)>0.10 mol/L |
| D、25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢能可再生,没有污染,现已用作火箭和燃料电池的燃料 |
| B、在环保领域,酸性或碱性废水的处理常常利用中和反应 |
| C、为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D、保护轮船船体,多采用外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、Ca2+、HCO3-、Cl- |
| B、Na+、AlO2-、Cl-、SO42- |
| C、Cu2+、Fe3+、Br-、MnO4- |
| D、K+、Fe3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
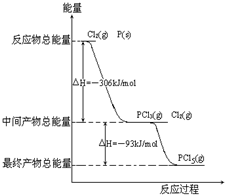
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com