
| A. | H2SO4 | B. | C2H5OH | C. | HNO3 | D. | NaOH |
分析 铜在加热的条件下,被氧化生成氧化铜,氧化铜与酸反应而溶解,导致铜的质量减小,氧化铜与乙醇在加热条件下反应生成铜,铜的总质量不变,以此解答该题.
解答 解:A.氧化铜和硫酸反应生成硫酸铜和水,质量减少,故A错误;
B.铜丝灼烧成黑色,立即放入C2H5OH中,CuO与C2H5OH反应:CuO+C2H5OH$\stackrel{△}{→}$CH3CHO+Cu+H2O,反应后铜丝质量保持不变,故B正确;
C.铜和氧化铜都与稀硝酸反应,铜的质量减小,故C错误;
D.NaOH溶液和氧化铜不反应,相对于铜丝,质量增大,故D错误.
故选B.
点评 该题是基础性试题的考查,试题难易适中,紧扣教材,有利于调动学生的学习兴趣,激发学生的学习积极性,提高学生的学习能力.该题的关键是明确在乙醇的催化氧化实验的机理,有利于培养学生的逻辑推理能力和创新思维能力.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 反应①配平后,H2O的化学计量数为4 | |
| B. | 若反应②有2mol电子发生转移,则生成1molNO3- | |
| C. | 反应③中生成物X为CO32- | |
| D. | 1L废水完全脱氮所需CH3OH的质量为0.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 原文 | 水火既济而土和 | 以曾青凃铁,铁赤色如铜 | 丹砂烧之成水银,积变又还成丹砂 | 欲去杂还纯,再入水煎炼,倾入盆中,经宿成白雪 |
| 解释 | 黏土烧结成陶瓷 | 金属的置换 | 物质间转化的可逆性 | 重结晶方法提纯物质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
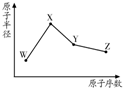 R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.
R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强. ,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);
,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);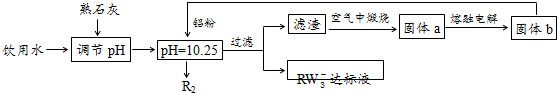
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝屑有氢气放出的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 常温下pH=12的溶液中:K+、Na+、CO32-、AlO2- | |
| C. | 在葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+ | |
| D. | 常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-14的溶液中:Al3+、NH4+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
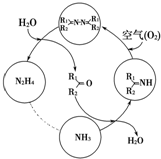 利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).
利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
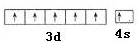 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com