
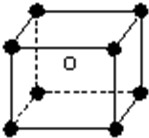
 某离子化合物的晶胞如图所示立体结构,阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是( )
某离子化合物的晶胞如图所示立体结构,阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是( )| A. | 1:8 | B. | 1:4 | C. | 1:1 | D. | 1:2 |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:填空题
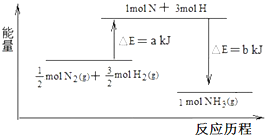 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关 | |
| B. | 由于键能H-R>H-T,故元素R、T对应气态氢化物的沸点:HR>HT | |
| C. | R与Q的电子数相差16 | |
| D. | 最高价氧化物对应的水化物的酸性:X<T<Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑥ | C. | ③④⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 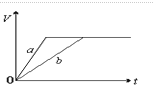 | B. | 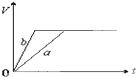 | ||
| C. | 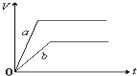 | D. | 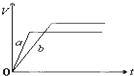 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾、漂白粉、臭氧的净水原理相同 | |
| B. | 硅胶可用作干燥剂 | |
| C. | 煤的干馏和石油的分馏都属于物理变化 | |
| D. | 亚硝酸钠是一种食品防腐剂,使用时其用量可以不加限制 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中:Na+、K+、Cl-、CO32- | |
| B. | 淀粉溶液中:K+、NH4+、SO42-、I- | |
| C. | Na2SiO3溶液中:Cl-、I-、K+、CO2 | |
| D. | 葡萄糖溶液中:Na+、H+、SO42-、Cr2O72- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 周期表里,元素所在的周期序数等于原子核外最外层电子数 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com