
【题目】研究CO2与CH4的反应使之转化为CO 和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知该转化反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH,则加快该反应的化学反应速率,应采用的有效措施有___________________________(填写两种)。
2CO(g)+2H2(g) ΔH,则加快该反应的化学反应速率,应采用的有效措施有___________________________(填写两种)。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH,测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g) ΔH,测得CH4的平衡转化率与温度、压强的关系如下图所示。

①由图可知,该反应的ΔH_____0 (填写“大于”或者“小于”),P1、P2、P3、P4由大到小的顺序为_________________________。
②工业生产时一般会选用P4和1250℃进行合成,请解释其原因______________________________。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为_________________mol·L-1·min-1。
④该温度下,反应的平衡常数K的数学表达式为K=_______,经计算K的数值为K=_____________(保留3位有效数字),若要使K减小可采取的措施是_________________。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) ![]() CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
① 在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是_______________
A. H2、CO和H2O的物质的量之比为1:1:1 B.体系压强不再变化
C. 气体平均相对分子质量不变 D.混合气体的密度保持不变
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向_______(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为________________。
【答案】 使用催化剂;升温;增大反应物浓度;增大压强 大于 P4>P3>P2>P1 较大的压强和温度能加快合成速率,提高生产效率 0.032 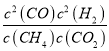 1.64 降温 BCD 逆 12g/mol
1.64 降温 BCD 逆 12g/mol
【解析】(1)加快反应的化学反应速率,可以采用的有效措施有使用催化剂;升温;增大反应物浓度;增大压强等,故答案为:使用催化剂;升温;增大反应物浓度;增大压强;
(2)①由图可知,升高温度,CH4的平衡转化率增大,平衡正向移动,正反应为吸热反应,ΔH大于0;温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,故答案为:大于;P4>P3>P2>P1;
②较大的压强和温度能加快合成速率,提高生产效率,工业生产时一般会选用P4和1250℃进行合成,故答案为:较大的压强和温度能加快合成速率,提高生产效率;
③由图1可知,压强为P4、1100℃的条件下,该反应5min时达到平衡X点,是甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,故v(CH4)= ![]() =0.016mol/(Lmin),根据速率之比等于化学计量数之比,所以v(CO)=2v(CH4)=2×0.16mol/(Lmin)=0.032mol/(Lmin),故答案为:0.032;
=0.016mol/(Lmin),根据速率之比等于化学计量数之比,所以v(CO)=2v(CH4)=2×0.16mol/(Lmin)=0.032mol/(Lmin),故答案为:0.032;
④ CH4(g)+CO2(g)=2CO(g)+2H2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故该温度下平衡常数k=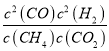 =
=![]() =1.64,若要使K减小,需要平衡逆向移动,由于K只与温度应该,可以采取的措施是降温,故答案为:
=1.64,若要使K减小,需要平衡逆向移动,由于K只与温度应该,可以采取的措施是降温,故答案为: 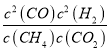 ;1.64;降温;
;1.64;降温;
(3)①A、H2、CO和H2O的物质的量之比为1:1:1,CO与H2的化学计量数为1:1,反应数值按物质的量比为1:1进行,不能说明到达平衡,故A错误;B、正反应方向是个气体体积增大的方向,故随着反应的进行,平衡之前,体系压强会增大,故一旦当体系压强不变,说明反应达平衡,故B正确;C、反应混合物的总质量不变,随反应进行,反应混合物的总的物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量不发生变化,说明到达平衡,故C正确;D、混合气体的密度ρ=![]() ,容器恒容,即V不变,随着反应的进行,混合气体的质量m增大,故ρ增大,一旦当ρ不变时,说明反应达平衡,故D正确;故选BCD;
,容器恒容,即V不变,随着反应的进行,混合气体的质量m增大,故ρ增大,一旦当ρ不变时,说明反应达平衡,故D正确;故选BCD;
②根据勒沙特列原理可知,增大压强,平衡向着气体体积减小的方向移动,此反应的逆反应方向是个气体体积减小的方向,故增大压强,向逆反应方向移动;在第2min时,混合气体的平均相对分子质量即平均摩尔质量![]() =
=![]() =
=![]() =12g/mol,故答案为:逆;12g/mol。
=12g/mol,故答案为:逆;12g/mol。


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】已知HCl(g)=1/2H2(g)+1/2Cl2(g) △H=+92.3kJ·mol-1,则反应H2(g)+Cl2(g)=2HCl(g)的△H为
A. ―92.3kJ·mol-1 B. -184.6kJ·mol-1
C. ―369.2kJ·mol-1 D. +184.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为人体内不同化学元素所组成的化合物,以下说法错误的是

A. 若图中①为某种生物大分子的基本单位,则①最可能是氨基酸
B. 若②遇苏丹Ⅲ染液出现橘黄色,则②最可能是脂肪
C. 若③能储存和传递遗传信息,则③一定是 DNA
D. 若④是人和动物的储能物质且主要分布在人体肝脏和肌肉内,则④最可能是糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明强酸性溶液中,能大量共存的离子组是( )
A.K+、Cu2+、NO3﹣、SO42﹣
B.K+、Na+、Cl﹣、CO32﹣
C.Zn2+、NH4+、NO3﹣、Cl﹣
D.K+、Na+、MnO4﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.硅元素在自然界里均以化合态存在B.SiO2硬度大,可用于制造光导纤维
C.NH3易溶于水,可用作制冷剂D.粗硅制备时,发生的反应为C+SiO2= Si +CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12L NO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。下列说法不正确的是

A. 可以求出合金中镁的质量 B. 氢氧化钠溶液浓度为3mol/L
C. 可以求出沉淀的最大质量 D. 不能求出硝酸的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中不正确的是( )
A. CS2为Ⅴ形的极性分子 B. ClO3-的空间构型为三角锥形
C. SF6中有6对完全相同的成键电子对 D. SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量。根据以上信息和数据,判断下列说法正确的是( )
N放出942 kJ热量。根据以上信息和数据,判断下列说法正确的是( )

A. N4属于一种新型的化合物 B. N4分子中存在非极性键
C. N4和N2是同分异构体 D. 1 mol N4转变成N2将吸收882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离下列三组混合物依次采取的方法正确的是:①碳酸钙和氯化钙的溶液 ②植物油和氯化钠溶液 ③氯化钠溶液和鸡蛋清( )
A.渗析、蒸馏、萃取
B.分液、萃取、蒸馏
C.过滤、分液、聚沉
D.过滤、分液、渗析
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com