
【题目】为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
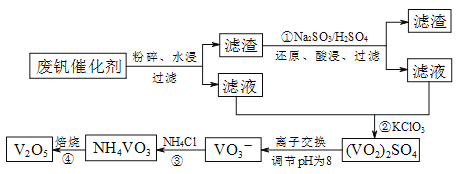
部分含钒物质在水中的溶解性如下:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)图中所示滤液中含钒的主要成分为 (写化学式)。
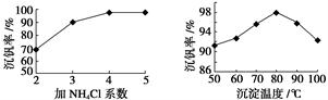
(2)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 和 。
(3)用硫酸酸化的H2C2O4溶液和(VO2)2SO4溶液反应,以测定反应②后溶液中含钒量,完成反应的离子方程式为:□VO2++□H2C2O4+□________=□VO2++□CO2↑+□H2O
(4)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2+ + V2+ + 2H+ ![]() VO2+ + H2O + V3+,电池放电时正极的电极反应式为 。
VO2+ + H2O + V3+,电池放电时正极的电极反应式为 。
【答案】(1)VOSO4
(2)NH4++VO3-=NH4VO3↓ ;4 ;80℃ ;
(3)2VO2++H2C2O4+2H+ = 2VO2++2CO2↑+2H2O VO2++2H+ + e- = VO2++H2O
【解析】
试题分析:
(1)根据溶解性表知,滤渣是V2O5,酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成VOSO4,图中所示滤液中含钒的主要成分为VOSO4;
(2)反应是复分解反应,反应的离子方程式是NH4++VO3-=NH4VO3↓。根据下图判断最佳控制氯化铵系数和温度为4和80℃沉钒率最大。
(3)根据化合价升降,反应的离子方程式为:2VO2++H2C2O4+2H+ = 2VO2++2CO2↑+2H2O
(4)①原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应。根据总的方程式可知VO2+得到电子被还原为VO2+,因此正极电极反应式是VO2++2H++e-=VO2++H2O。


科目:高中化学 来源: 题型:
【题目】SO2和NOx都是大气污染物。
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是____________。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知:① N2(g)+O2(g) = 2NO(g)ΔH=+180.6 kJ·mol-1
②C(s)+O2(g) = CO2(g)ΔH=-393.5 kJ·mol-1
则反应C(s)+2NO(g) = CO2(g)+N2(g)ΔH=________kJ·mol-1。
(3)利用氨水可以将SO2和NO2吸收,原理如下图所示:
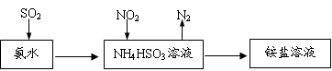
NO2被吸收的离子方程式是_________________________
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
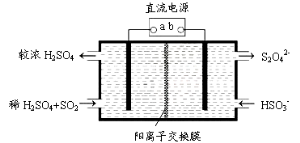
①b极的电极反应式为____________
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为____________
(5)已知水的比热容为4.18×10-3 kJ·g-1·℃-1,10 g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500 g H2O的温度由18 ℃升至62.4 ℃,则表示硫黄的燃烧热的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育,中学生每天要补充60mg的维生素C。下列物质含有丰富维生素C的是 (填字母)。
A.牛肉 B.辣椒 C.鸡蛋
②青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损害,该微量元素是 ( 填字母)
A.碘 B.铁 C.钙
③蛋白质是人体必需的营养物质,它在人体内最终分解为 (填字母)。
A.葡萄糖 B.氨基酸 C.脂肪酸
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是 。
②玻璃是重要的硅酸盐产品。生产玻璃时,石灰石与石英反应的化学方程式为 。
③铁是人们生活中常用的金属材料,请列举两种防止铁制品被腐蚀的方法: , 。
(3)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
①空气质量报告的各项指标可以反映出各地的空气质量。下列各项中目前未列入我国空气质量报告的是 (填字母)。
A.SO2
B.NO2
C.CO2
D.PM2.5
E.氯氟烃
②垃圾应分类收集。以下物质应放置于贴有“![]() ”标志垃圾筒的是 (填字母)。
”标志垃圾筒的是 (填字母)。
A.废电池 B.废铝制的易拉罐 C.建筑固弃物、渣土
③pH< 的雨水称为酸雨;向煤中加入适量的 ,可以大大减少燃物产物中SO2的量。
④天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。加入ClO2的作用是 。
⑤对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体化学元素和化合物的叙述,正确的是
A. 核糖核酸是染色体和核糖体的主要成分之一
B. 在人体活细胞中氢原子的数目最多
C. 蛋白质区别于脂质的特有元素是氨
D. 核酸、核糖、核苷酸都含有元素C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学变化属于加成反应的是
A.乙醇在铜作催化剂的条件下加热和空气的反应
B.乙烯通入溴的四氯化碳溶液中的反应
C.甲烷在光照条件下与氯气发生的反应
D.苯与液溴在铁粉作催化剂的条件下发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和生活中有着重要的应用。下列说法正确的是 ( )
A.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料
C.白酒中混有少量塑化剂,可通过过滤除去
D.能够改善食品的色、香、味,并有防腐、保鲜作用的食品添加剂应限量使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素:反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH)2·H2O2。过氧化尿素的部分性质如下:
CO(NH)2·H2O2。过氧化尿素的部分性质如下:
合成过氧化尿素的流程及反应装置图如下:
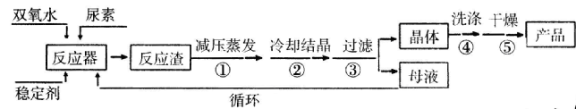
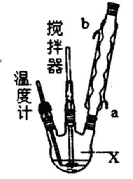
请回答下列问题:
(1)仪器X的名称是____________;冷凝管中冷却水从____________(填“a”或“b”)口进入。
(2)反应器的加热方式是_______________。
(3)搅拌器是否可用铁质材料___________(填“是”或“否”),原因是_______________。
(4)步骤① 采用减压蒸发的原因是___________。
(5)下列选项中,最适合作为步骤④ 的洗涤液是_______。
a.冰水 b.热水 c.饱和NaCl溶液 d.酒精和水的混合液
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol/L H2SO4,用0.1000 mol/L KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应)。
① 滴定终点的现象是______________。
② 则产品中CO(NH)2·H2O2的质量分数为______________。
③ 若滴定前仰视,滴定后俯视,则测得的过氧化尿素含量_________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是( )
A.盐卤可用于制作豆腐
B.从海水中提取物质都要通过化学反应才能实现
C.煤经过气化和液化等物理变化可转化为清洁燃料
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com