
【题目】SO2和NOx都是大气污染物。
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是____________。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知:① N2(g)+O2(g) = 2NO(g)ΔH=+180.6 kJ·mol-1
②C(s)+O2(g) = CO2(g)ΔH=-393.5 kJ·mol-1
则反应C(s)+2NO(g) = CO2(g)+N2(g)ΔH=________kJ·mol-1。
(3)利用氨水可以将SO2和NO2吸收,原理如下图所示:
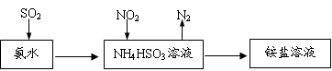
NO2被吸收的离子方程式是_________________________
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
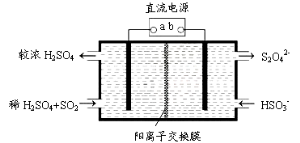
①b极的电极反应式为____________
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为____________
(5)已知水的比热容为4.18×10-3 kJ·g-1·℃-1,10 g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500 g H2O的温度由18 ℃升至62.4 ℃,则表示硫黄的燃烧热的热化学方程式为________________。
【答案】(1)2CO+2NO![]() 2CO2+N2;
2CO2+N2;
(2)-574.1 ;
(3)2NO2+4HSO3- = N2+4SO42-+4H+
(4)① 2HSO3- +2e- = S2O42-+2OH- ② 4S2O42- + 2NO2 + 8OH- = 8SO32- + N2+4 H2O
(5)S(s)+O2(g)===SO2(g) ΔH=-296.9 kJ·mol-1
【解析】
试题分析:
(1)CO和NO2通过催化转化器将其转化为无污染的两种气体是氮气和二氧化碳,反应为2CO+2NO![]() 2CO2+N2;
2CO2+N2;
(2)① N2(g)+O2(g) = 2NO(g) ΔH=+180.6 kJ·mol-1
②C(s)+O2(g) = CO2(g)ΔH=-393.5 kJ·mol-1,
根据盖斯定律②-①得C(s)+2NO(g) = CO2(g)+N2(g)ΔH=-574.1kJ·mol-1 ;
(3)NO2被吸收的反应物为NO2、NH4HSO3,二氧化氮中氮元素为+4价,生成物有氮气,所以亚硫酸氢根离子中硫被氧化成硫酸根离子,反应为2NO2+4HSO3-=N2+4SO42-+4H+,
(4)①依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2-2e-+2H2O═SO42-+4H+,阳极与电源的正极相连,a是正极,b是负极,阴极排出的溶液为S2O42-,b极的电极反应式为2HSO3- +2e- = S2O42-+2OH- ②阴极排出的溶液为S2O42-,二氧化氮与其发生反应,S2O42-中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42-被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O。
(5)10 g硫磺燃烧共放出热量为:=500 g × 4.18 × 10-3kJ/(g·C)-1 × (62.4 - 18)C = 92.8 kJ,则lmol(32g)硫磺燃烧放热为-296.9 kJmol-1,硫磺的燃烧热为297 kJmol-1,热化学方程式为:S(s) + O2(g) = SO2(g);△H=-296.9 kJmol-1


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z 在元素周期表中的位置如图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
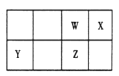
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
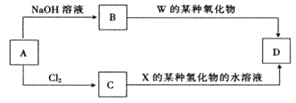
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式__________________。
(2)下列三种情况下,离子方程式与(1)相同的是__________(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
若在A项所得溶液中,继续滴加Ba(OH)2溶液,此步反应的离子方程式为:________________
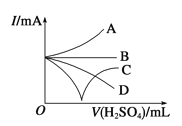
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用右上图中的 曲线表示(填序号)。
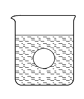
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属冶炼的说法正确的是
A.金属Mg只能用热还原法制备 B.高炉炼铁的原理是用CO还原铁矿石
C.电解AlCl3制金属Al D.用热还原法制金属Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。被氧化的元素是 ,氧化剂是 ,还原产物是 。电子转移的总数为__________。
(2)国家卫生部在2000年前就决定逐步使用稳定、高效、无毒的二氧化氯取代氯气消毒饮用水。已知二氧化氯溶于水时有亚氯酸根离子(ClO2-)生成,且氧化产物与还原产物的物质的量之比为1∶1。二氧化氯溶于水的反应方程式2ClO2 + H2O=HClO3 + HClO2,请用单线桥标明电子转移方向和数目并指出氧化产物。2ClO2 + H2O=HClO3 + HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是( )
A.称取3 g 左右的干海带——托盘天平
B.灼烧干海带至完全变成灰烬——蒸发皿
C.过滤煮沸后的海带灰和水的混合物——漏斗
D.用四氯化碳从氧化后的海带灰浸取液中提取碘——分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用稀硝酸腐蚀废锌板后得到“烂版液”(含有微量的Cl-、Fe3+),某化学兴趣小组拟用该“烂版液”制取Zn(NO3)2·6H2O的过程如下:
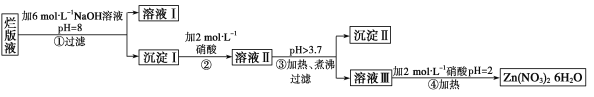
已知: Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)为检验“烂版液”中的Fe3+,下列试剂可选择的是 (填选项的代号)
A、NaOH溶液 B、KSCN溶液 C、K3[Fe(CN)6] 溶液 D、NaCl溶液
(2)若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式_________。
(3)在操作①中保持pH=8的目的是___________;操作④保持pH=2的目的是__________________;
(4)操作③中加热、煮沸的目的是___________________________;
(5)沉淀Ⅱ的主要成分是______________________。
(6)已知金属活泼性不同,其硝酸盐的分解产物也不同。
2KNO3=2KNO2+O2↑ 4Fe(NO3)2=2Fe2O3+8NO2↑+O2↑ 2Zn(NO3)2=2ZnO+4NO2↑+O2↑
某同学取KNO3、Zn(NO3)2、Fe(NO3)2混合粉末充分加热后,用排水法未收集到任何气体,则KNO3、 Zn(NO3)2、Fe(NO3)2的物质的量之比为 (填选项的代号)
A、2︰1︰3 B、1︰2︰2 C、1︰2︰3 D、3︰8︰5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.油脂水解可得到氨基酸
B.蛋白质水解可以得到高级脂肪酸
C.维生素是一类高分子化合物
D.淀粉和纤维素的组成的化学式可表示为(C6H10O5)n,水解最终产物都是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
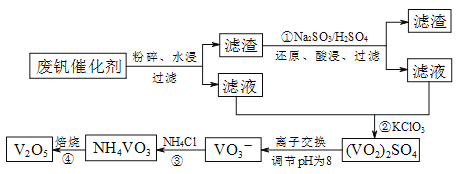
部分含钒物质在水中的溶解性如下:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)图中所示滤液中含钒的主要成分为 (写化学式)。
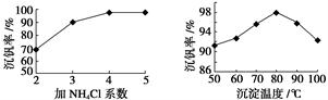
(2)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 和 。
(3)用硫酸酸化的H2C2O4溶液和(VO2)2SO4溶液反应,以测定反应②后溶液中含钒量,完成反应的离子方程式为:□VO2++□H2C2O4+□________=□VO2++□CO2↑+□H2O
(4)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2+ + V2+ + 2H+ ![]() VO2+ + H2O + V3+,电池放电时正极的电极反应式为 。
VO2+ + H2O + V3+,电池放电时正极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com