
【题目】短周期元素 W、X、Y、Z 在元素周期表中的位置如图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
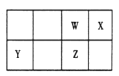
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
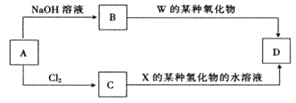
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。
【答案】(1)第二周期第IVA族
(2)![]()
(3)CD
(4)NaAlO2; Al3++3AlO2-+6H2O=Al(OH) 3↓
【解析】试题分析:短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域,则Z是硅,因此W是C,X是N,Y是Mg。
(1)碳元素的原子序数是6,在元素周期表中的位置是第二周期第ⅣA族 。
(2)C、N、H元素形成的三原子分子是HCN,电子式![]()
(3)A.非金属性强弱与原子序数没有关系,A错误;B.非金属性强弱与最低化合价没有关系,B错误;C.非金属性越强,氢化物的稳定性越强,则最简单氢化物的稳定性:X>W可以说明元素非金属性X强于W,C正确;D.非金属性越强,最高价氧化物对应水化物的酸性越强,则最高价氧化物的水化物酸性:X>W可以说明元素非金属性X强于W,D正确,答案选CD。
(4)金属元素形成的单质A能与氢氧化钠溶液反应生成B,也能与氯气反应生成C,C与氨气反应生成D,化合物D是一种白色沉淀,这说明A是铝,B是偏铝酸钠,C是氯化铝,D是氢氧化铝,则B中溶质的化学式为NaAlO2,偏铝酸钠能与CO2反应生成氢氧化铝沉淀。氯化铝与偏铝酸钠直接转化生成氢氧化铝,对应的离子方程式为Al3++3AlO2-+6H2O=Al(OH) 3↓。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 常温常压下,1.06 g Na2CO3溶于水含有的Na+离子数为0.02 NA
C. 通常状况下,NA个CO2分子占有的体积为22.4 L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.平衡时,X的转化率为20%
B.2min时Y的物质的量为0.14
C.增大平衡后的体系压强,v(正)增大,v(逆)减小
D.2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol·L―1·min―1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法中正确的是( )
A.该原子的摩尔质量是a NA
B.ωg该原子的物质的量一定是![]() mol
mol
C.ωg该原子中含有![]() ×NA个该原子
×NA个该原子
D.由已知信息可得:NA =![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法不正确的是( )
A. 二茂铁属于分子晶体
B. 在二茂铁结构中,C5H![]() 与Fe2+之间形成的化学键类型是离子键
与Fe2+之间形成的化学键类型是离子键
C. 已知:环戊二烯的结构式为: ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
D. C5H![]() 中一定含π键
中一定含π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. C元素因其在细胞的干重中含量最高,所以C是生命的最基本元素
B. C原子构成的碳链是生物大分子的基本骨架
C. C、H、O、N是蛋白质和糖类中共有的4种元素
D. 构成细胞的微量元素就是指细胞中含量很少且可有可无的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y![]() 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
A. 33% B. 40% C. 50% D. 65%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx都是大气污染物。
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是____________。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知:① N2(g)+O2(g) = 2NO(g)ΔH=+180.6 kJ·mol-1
②C(s)+O2(g) = CO2(g)ΔH=-393.5 kJ·mol-1
则反应C(s)+2NO(g) = CO2(g)+N2(g)ΔH=________kJ·mol-1。
(3)利用氨水可以将SO2和NO2吸收,原理如下图所示:
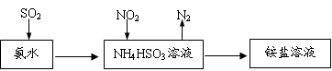
NO2被吸收的离子方程式是_________________________
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
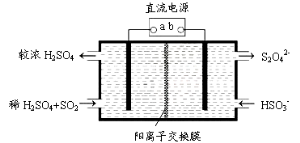
①b极的电极反应式为____________
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为____________
(5)已知水的比热容为4.18×10-3 kJ·g-1·℃-1,10 g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500 g H2O的温度由18 ℃升至62.4 ℃,则表示硫黄的燃烧热的热化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com