
【题目】苯与甲苯相比较,下列说法不正确的是
A.都能在空气燃烧产生浓烟
B.苯不能使酸性的高锰酸钾溶液褪色,甲苯能使酸性的高锰酸钾溶液褪色
C.都不能因反应而使溴水褪色
D.苯比甲苯更容易与硝酸反应
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下列有关用惰性电极电解AgNO3溶液一段时间后的说法正确的是
A. 电解后两极产生的气体体积比为2∶1
B. 电解过程中溶液的pH不断升高
C. 此时向溶液中加入适量的Ag2CO3固体可使溶液恢复电解前的状况
D. 电解过程中阴极质量不断减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A. 某钾盐K2A 的水溶液显碱性,其原因是:A2-+2H2O ![]() H2A+2OH-
H2A+2OH-
B. 碳酸氢根离子的电离:HCO3—+H2O ![]() CO32—+ H3O+
CO32—+ H3O+
C. 碳酸氢铵溶液与足量的NaOH溶液混合加热:NH![]() +OH-
+OH-![]() NH3↑+ H2O
NH3↑+ H2O
D. 在Ba(HCO3)2溶液中逐滴滴入NaHSO4 溶液至Ba2+恰好完全沉淀时: Ba2++2HCO3-+2H++SO42-![]() BaSO4↓+2CO2↑+2H2O
BaSO4↓+2CO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理。某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性。
方案Ⅰ:甲同学设计如下装置制备氯化亚铁。
已知:实验室常用氯化钠固体与浓硫酸共热制备氯化氢;氯化亚铁能与水蒸气剧烈反应。
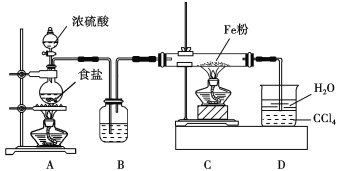
(1)写出A中反应的化学方程式: _______________。B中盛装的试剂为____________________,D装置中四氯化碳的作用是_____________。
(2)实验过程中,观察到D中现象是___________________________________________。
用物理方法检验氯化亚铁产品中是否混有铁粉:______________。
(3)上述方案有明显不足,请你提出改进上述方案的建议:______________________。方案Ⅱ:乙同学选择下列装置用氯化铁制备少量氯化亚铁(装置可以重复使用,氯化铁遇水剧烈水解)。查阅资料知,在加热条件下,氢气还原氯化铁生成氯化亚铁和氯化氢。
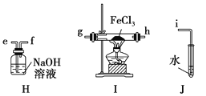
(4)气流从左至右,装置接口连接顺序是a______________________________________。
(5)设计简单实验证明氢气和氯化铁已发生反应:__________________________________。
(6)为了探究上述实验制备的氯化亚铁(Fe2+)具有还原性,设计如下方案:
a.取少量氯化亚铁样品溶于蒸馏水,滴加酸性高锰酸钾溶液,观察现象
b.取少量氯化亚铁样品溶于蒸馏水,滴加酸化的双氧水和KSCN溶液,观察现象
c.取少量氯化亚铁样品溶于蒸馏水,滴加铁氰化钾溶液,观察现象
d.取少量氯化亚铁样品溶于蒸馏水,先加KSCN溶液,后加氯水,观察现象
上述方案合理的是________(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是( )
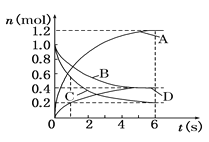
A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:N2(g)+3H2(g)=2NH3(g),有关物质的化学键键能(拆开1 mol化学键所需要的能量)如下:
化学键 | N≡N | N—H | H—H |
键能(kJ/mol) | 945.0 | 391.0 | 436.0 |
计算该反应生成2 mol NH3时吸收或放出的热量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某科研小组研究:在恒温、恒容(容器容积为2L,)下N2(g)+3H2(g)![]() 2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
①此条件下反应的平衡常数K= 。
②若初始条件n (NH3)= 2mol,反应达到平衡时NH3的转化率为 ,
③若初始条件n (H2)= 6mol 、n (N2) =2mol,反应达到平衡时NH3的体积分数 43%,此时移除0.5 mol NH3 ,再次达到平衡时NH3的体积分数 43% (填 “>、<、=”)
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g),ΔH>0
4NO2(g)+O2(g),ΔH>0
①下表为该反应在T1温度下的部分实验数据
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 。
②现以NO2、O2、N2O5、熔融盐NaNO3组成的燃料电池,采用电解法制备N2O5,装置如图所示。

写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com