
 ,
, ;
; 

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
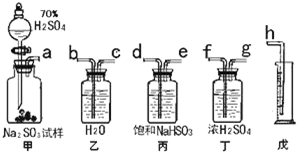 某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.
某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.
| 操作1 | 沉淀质量 | Na2SO3%计算表达式 | |
| 甲 | 先往溶液中加入足量盐酸,再滴入足量BaCl2 | b克 | (1-142b/233a)×100% |
| 乙 | 先往溶液中加入足量Ba(NO3)2,再滴入足量盐酸 | c克 | (1-142c/233a)×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCOOCH2CH2CH3 |
| B、CH3COOCH2CH3 |
| C、CH3CH2COOCH3 |
| D、HOCH2CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为 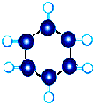 |
| C | ①由C、H、O三种元素组成: ②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2; ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液起始读数 | NaOH溶液终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.20mL | 18.50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
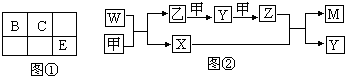
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 |
| B、只用少量水就可鉴别Na2CO3和NaHCO3固体 |
| C、用FeSO4、NaOH和盐酸等试剂在空气中可以制备纯净的FeCl3溶液 |
| D、用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com