
下列说法正确的是( )
A.难溶电解质作比较时,Ksp小的,溶解度一定小
B.Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀溶解平衡会发生移动
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去
D.温度一定,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
下图为一种新型的生物燃料电池,它有两个涂覆着酶的电极,处于充满空气和少量氢气的玻璃槽中,由于气体可以混合从而省去了昂贵的燃料隔离膜。下列对其工作原理叙述正确的是( )
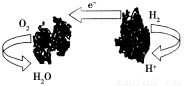
A.该电池工作过程中,H+浓度不断增大
B.该电池在高温环境下能提供更好的动力
C.该电池负极反应为:H2-2e-=2H+
D.该电池正极反应为:O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-2练习卷(解析版) 题型:选择题
用铂电极电解一定浓度的下列物质的水溶液,在电解后的电解液中加适量水,能使溶液浓度恢复到电解前浓度的是( )
A.NaCl B.Na2CO3 C.CuSO4 D.K2S
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:填空题
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
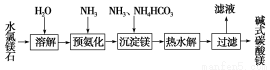
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol·L-1,则溶液中c(Mg2+)= 。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数 (填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:选择题
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-3练习卷(解析版) 题型:选择题
H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol·L-1 NaHSO3溶液中,下列关系正确的是( )
A.c(HSO3-)>c(SO32-)>c(H2SO3)
B.c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3)
C.c(Na+)=c(HSO3-)>c(H+)>c(OH-)
D.c(Na+)+c(H+)=c(HSO3-)+c(OH-)+c(SO32-)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-3练习卷(解析版) 题型:选择题
下列溶液在空气中加热、蒸干、灼烧后,所得固体为原溶液中的溶质的是( )
A.NaHCO3 B.KMnO4 C.FeCl3 D.NaCl
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-1练习卷(解析版) 题型:填空题
炼金废水中含有络离子[Au(CN)2]-,其电离出的CN-有毒,当CN-与H+结合生成HCN时,毒性更强。回答下列问题。
(1)剧毒物HCN的水溶液酸性很弱,写出其电离的方程式: 。
(2)与弱电解质碳酸的电离方式相似,[Au(CN)2]-也存在着两步电离,其一级电离方程式为 。
(3)处理这种废水是在碱性条件下,利用NaClO将CN-氧化为CO32-和N2,其离子方程式为 。在酸性条件下,ClO-也能氧化CN-,但实际处理废水时却不在酸性条件下进行的主要原因是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-2练习卷(解析版) 题型:选择题
在水溶液中存在反应:Ag++Fe2+ Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
A.升高温度 B.加水稀释
C.增大Fe2+的浓度 D.常温下加压
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com