
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||||
| ⑨ | ⑩ | ||||||||||||||||
| ||
| ||
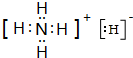 ,故答案为:
,故答案为: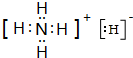 ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、产物B的状态只能为固态或液态 |
| B、平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 |
| C、保持体积不变,向平衡体系中加入B,平衡不可能向逆反应方向移动 |
| D、若开始时向容器中加入1mol B和1mol C,达到平衡时放出热量QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
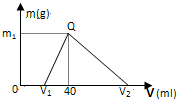 (1)15.6g Na2X含Na+0.4moL,则Na2X的摩尔质量为
(1)15.6g Na2X含Na+0.4moL,则Na2X的摩尔质量为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 元 素 | O | P | |
| 电离能 kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H2分子的结构式:H-C≡C-H |
| B、NaH与重水反应的方程式:NaH+D2O=NaOH+D2↑ |
C、S2-的结构示意图: |
D、二氧化碳的电子式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com