
【题目】铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池充电过程中,阴极附近溶液的酸性增强
C. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
【答案】B
【解析】Ni(OH)2、Fe(OH)2都属于碱,则该电池中电解质溶液为碱性溶液,放电时为原电池原理,反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,负极为Fe,其电极反应式为Fe-2e-+2OH-=Fe(OH)2,Ni2O3为正极,其电极反应式为Ni2O3+2e-+3H2O=2Ni(OH)2+2OH-,A、C项正确;充电时为电解池原理,反应为Fe(OH)2+2Ni(OH)2=Fe+Ni2O3+3H2O,阴极电极反应式为Fe(OH)2+2e-=Fe+2OH-,阴极附近溶液的碱性增强,B项错误;阳极电极反应式为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,D项正确;答案选B。


科目:高中化学 来源: 题型:
【题目】将淀粉浆和淀粉酶的混合物放入玻璃纸袋中,扎好,浸入流动的温水中,相当长一段时间后,取袋中液体分别与碘水、新制Cu(OH)2(加热)和浓HNO3(微热)作用,其现象为
A. 显蓝色、无现象、显黄色 B. 显蓝色、红色沉淀、无现象
C. 无现象、无现象、显黄色 D. 无现象、红色沉淀、无现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示. 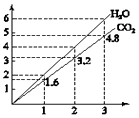
①一定有C2H4
②一定有CH4
③一定有C3H8
④一定没有C2H6
⑤可能有C2H2
则上述对该混合烃的判断正确的是( )
A.②③⑤
B.⑤⑥
C.②④⑥
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )

A. Z中溶液的pH增大
B. Cu电极质量减小,Pt电极质量增大
C. 溶液中的SO![]() 向Cu电极定向移动
向Cu电极定向移动
D. 滤纸上c点附近会变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H10的苯的同系物,其同分异构体共有a种,所有同分异构体的一氯代物共有b种,则a、b的值分别为: ( )
A. 3,14 B. 4,13 C. 3,13 D. 4,14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲将反应2Fe3++Cu═Cu2++2Fe2+设计成原电池,该电池负极材料为 , 电解质溶液为 , 10min内该电池向外提供0.2mol电子,负极材料的质量变化为 , 假设该电解质溶液为1L,则以Fe3+浓度变化表示的该反应的速率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0 kJ·mol-1 C(石墨)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为____________。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H

①该反应的平衡常数表达式为K=__________。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH_____0(填“>”、“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”、“<”或“=”)。

(3)以CO2为原料还可以合成多种物质,用硫酸溶液作电解质进行电解,CO2在电极上可转化为CH4,该电极应与电源 ___________(填“正极”、“负极”)相连,其电极反应的方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g)![]() H2(g)+I2(g);则下列有关说法正确的是
H2(g)+I2(g);则下列有关说法正确的是
A. 如改变体系温度,体系颜色一定发生变化
B. 如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移
C. 继续充入HI气体,则HI的转化率将减小
D. 温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com