
【题目】下列实验方案正确且能达到实验目的的是( )
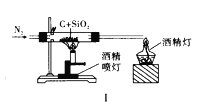
A. 图Ⅰ比较碳、硅两元素非金属性的强弱
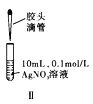
B. 图Ⅱ先滴加5滴![]() 的
的![]() 溶液,再滴加5滴
溶液,再滴加5滴![]() 的
的![]() 溶液。比较
溶液。比较![]() 与
与![]() 溶解度的大小
溶解度的大小
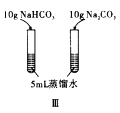
C. 图Ⅲ已知溶解度(20℃)![]() :
:![]() ;
;![]() :
:![]() 。室温下,比较
。室温下,比较![]() 和
和![]() 溶解度的大小
溶解度的大小
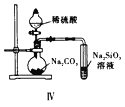
D. 图Ⅳ证明碳酸的酸性比硅酸强
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】① NaOH ② CH3COOH ③ NaHCO3 ④ HCl溶液是中学化学中常用的四种物质。
(1)pH相同的CH3COOH和HCl溶液比较,物质的量浓度较大的是____(填序号)。
(2)等体积、等物质的量浓度的CH3COOH和HCl溶液与足量的NaHCO3固体粉末反应,起始反应速率较小的是_______填序号)。
(3)常温下,pH均为10的 NaOH和NaHCO3 溶液,由水电离出的c(OH—)之比为_________________。
(4)常温下,用 0.10 mol/L NaOH溶液滴定 20.00 mL 0.10 mol/L CH3COOH溶液,
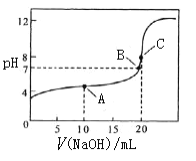
①A点溶质为____________(写化学式),此时c(CH3COO-)_______c(CH3COOH)(填“大于” 、“小于”或“等于”),溶液中水的电离平衡______(填“被抑制”或“被促进”或“无影响”)
②结合化学用语,解释C点pH=8的原因_______________________________________ 。
③下列关于B点的判断正确的是____
a.醋酸和氢氧化钠恰好完全反应
b.混合液中的微粒种类共四种
c.c(CH3COO-) = c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制1.0mol/L的氢氧化钠溶液480mL。完成下列各题。
(1)应选择规格为_______mL的容量瓶,该容量瓶上除注明规格外,还______________(选填编号)。
a.温度 b.浓度 c.压强 d.刻度线
(2)用电子天平称取_____gNaOH。
(3)将称好的氢氧化钠固体加适量蒸馏水将其溶解,待冷却后将溶液移入容量瓶中。
(4)用少量蒸馏水冲洗________________2~3次,将洗液移入容量瓶中。
(5)向容量瓶内加水至接近刻度1~2cm处,改用胶头滴管小心地加水至刻度线。
(6)最后塞好瓶塞,摇匀,将配好的溶液移入试剂瓶中并贴好标签。
(7)分析下列操作可能会对氢氧化钠溶液浓度造成的影响(填“偏高”、“偏低”或“无影响”)。
①氢氧化钠溶解后,未冷却即转移_________。
②定容时仰视___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是
A.摩尔是一个物理量,它表示含有一定数目粒子的集合体
B.摩尔是物质的量的单位,简称摩,符号为mol
C.国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔
D.1摩尔任何物质均含有6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
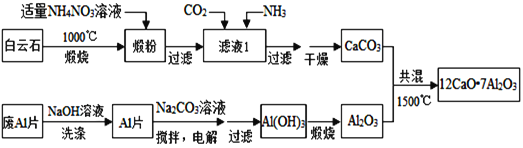
(1)锻粉主要含______和______,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶。该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_______________________________________________.
(2)滤液Ⅰ中阴离子有______(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成______,从而导致CaCO3产率降低.
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为______________________.
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,则铝片接外电源的____极,电解时阴极发生的反应为:______.
(5)一种可超快充电的新型铝电池,充放电时AlCl4﹣和Al2Cl7﹣两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后______(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是氢氧燃料电池的示意图,按图中提示,下列叙述不正确的是( )

A. a电极是负极,b电极是正极
B. a电极的电极反应式为H2-2e-===2H+
C. b电极的电极反应式为4OH--4e-===2H2O+O2↑
D. 氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 和
和![]() 为原料可合成尿素
为原料可合成尿素![]() ,反应为:
,反应为:![]() 。达到平衡时,
。达到平衡时,![]() 的转化率
的转化率![]() 随温度变化的情况如下图。下列说法不正确的是( )
随温度变化的情况如下图。下列说法不正确的是( )

A. 该反应的![]()
B. 若y为压强,则![]()
C. 若y表示反应起始时的水碳比(![]() ,则
,则![]()
D. 在恒温恒容(2L)的容器和绝热恒容(2L)容器中,分别加入![]() 和
和![]() ,达到平衡时,恒温恒容体系中氨气的转化率大于绝热恒容体系中氨气的转化率
,达到平衡时,恒温恒容体系中氨气的转化率大于绝热恒容体系中氨气的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的是(夹持仪器未画出)( )

A. 装置①用于检验溴乙烷消去生成的乙烯 B. 装置②用于石油的分馏
C. 装置③用于实验室制硝基苯 D. 装置④可证明酸性:盐酸>碳酸>苯酚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com