
【题目】元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子最外层电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素組成的二元化合物,甲、乙分别是元索X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一。0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示。下列说法正确的是
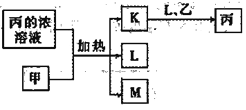
A. 丙不能由W、Y組成的某种化合物与K直接反应制得
B. K、I、M中沸点最高的是M
C. 最简单氢化物的热稳定性:Y>Z
D. 元素的非金属性:Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是
A.混合物:空气、矿泉水、水银
B.酸性氧化物:、CO2、SO2、CO
C.盐:醋酸钠、氯化铵、纯碱
D.弱电解质:CH3COOH、H2O、NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种难溶电解质的溶度积如下表所示:
几种难溶电解质的Ksp(25℃) | |
沉淀溶解平衡 | Ksp |
AgBr(s) | 5,0×10-13 mol2·L-2 |
AgI(s) | 8.3×10-17 mol2·L-2 |
FeS(s) | 6.3×10-18 mol2·L-2 |
ZnS(s) | 1.6×10-24 mol2·L-2 |
CuS(s) | 1.3×10-36 mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺为:____________________。
(2)向饱和的AgI溶液中加入固体硝酸银,则c( I- )________(填“增大”、“减小”或“不变”),若改加AgBr固体,则c(Ag+)__________(填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是_____________________(用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡: ZnS(s)![]() Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图示分析正确的是( )
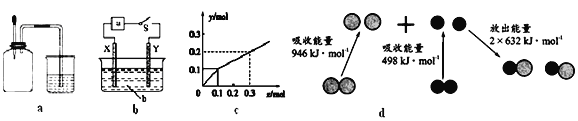
A. 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并全部充满集气瓶
B. 如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a
C. Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+
D. 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=-180 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 碳酸钙不溶于水,但溶于盐酸
B. 由2NO2(g)![]() N2O4(g)组成的平衡体系,加压后颜色加深
N2O4(g)组成的平衡体系,加压后颜色加深
C. 高压比常压有利于合成氨的反应
D. 用热的纯碱溶液洗油污时,去污效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2+7O2![]() 2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4
2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4![]() MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是
A. MoS2煅烧产生的尾气可直接排空
B. MoO3是金属氧化物,也是碱性氧化物
C. H2MoO4是一种强酸
D. 利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子半径的大小顺序正确的是( )
①2s22p2 ②3s23p3 ③2s22p4 ④3s23p2
A. ③>④>②>① B. ④>③>②>①
C. ④>③>①>② D. ④>②>①>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com