
| A. | 在NaA1O2溶液中:K+、HCO3-、SO42-、NH4+ | |
| B. | 在饱和氯水中:C1-、Na+、NO3-、Al3+ | |
| C. | 在KSCN溶液中:NO3-、Fe3+、SO42-、Na+ | |
| D. | 在c(H+)/c(OH-)=1×10-14的溶液中:SO32-、Na+、ClO-、K+ |
分析 A.碳酸氢根离子的酸性大于氢氧化铝,偏铝酸钠与碳酸氢根离子反应生成氢氧化铝沉淀和碳酸根离子;
B.四种离子之间不反应,都不与氯水反应;
C.铁离子与硫氰化钾反应生成络合物硫氰化铁;
D.次氯酸根离子具有强氧化性,能够氧化亚硫酸根离子.
解答 解:A.HCO3-的酸性大于氢氧化铝,NaA1O2与HCO3-反应生成氢氧化铝沉淀和碳酸根离子,在溶液中不能大量共存,故A错误;
B.C1-、Na+、NO3-、Al3+之间不发生反应,都不与氯水反应,在溶液中能够大量共存,故B正确;
C.Fe3+与KSCN溶液反应生成硫氰化铁,在溶液中不能大量共存,故C错误;
D.SO32-、ClO-之间发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:推断题
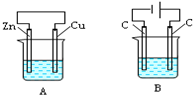 如图所示,A、B两个装置中两个烧杯分别盛有足量的CuSO4溶液:
如图所示,A、B两个装置中两个烧杯分别盛有足量的CuSO4溶液:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol | B. | 0.15 mol | ||
| C. | 大于0.15mol,小于0.3mol | D. | 小于0.15mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
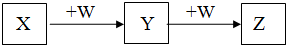 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去),下列说法不正确的是( )
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去),下列说法不正确的是( )| A. | 若W是氢氧化钠,则X与Z可反应生成Y | |
| B. | 若X是硝酸银溶液,则W是氨水 | |
| C. | 若X是H2S,则X、Z的相对分子质量相差可能为30或46 | |
| D. | 若W是单质铁,则Z是FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com