
【题目】Hg可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示。下列有关说法不正确的是
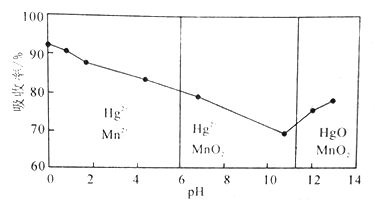
A. pH对Hg吸收率的影响规律是随pH升高Hg的吸收率先降低后升高
B. pH=l时Hg的吸收率高达90%的原因是KMnO4在酸性条件下氧化性强
C. pH = 2时反应的离子方程式为Hg+MnO4-+8H+=Hg2++Mn2++4H2O
D. pH = 12时反应的离子方程式为3Hg+2MnO4-+ H2O=3HgO+2MnO2+2OH-
科目:高中化学 来源: 题型:
【题目】在淀粉—KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I
I![]() (aq)。测得不同温度下该反应的平衡常数K如表所示:
(aq)。测得不同温度下该反应的平衡常数K如表所示:
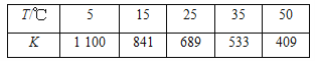
下列说法正确的是( )
A. 反应I2(aq)+I-(aq)![]() I
I![]() (aq)的ΔH>0
(aq)的ΔH>0
B. 其他条件不变,升高温度,溶液中c(I![]() )减小
)减小
C. 该反应的平衡常数表达式为K=![]()
D. 25 ℃时,向溶液中加入少量KI固体,平衡常数K大于689
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方式不正确的是:
A. 漂白粉需要密封保存 B. FeCl3溶液保存时加入少量铁粉
C. 钠应保存在煤油中 D. 液氯应储存在钢瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 39gNa2O2与CO2完全反应,转移的电子数为![]()
B. 6.0gNO和3.2gO2混合,所得气体的分子数目为0.2![]()
C. 84gFe完全转化为Fe3O4,失去的电子数为4![]()
D. 1molCu和2mol热浓硫酸反应,生成SO2分子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池为使用一次后就被废弃的电池,因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
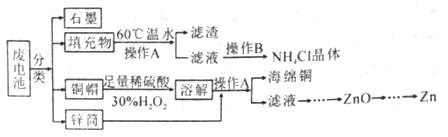
(1)用60℃温水溶解填充物,目的是________。
(2)操作B的名称为_____________。
(3)铜帽溶解的化学方程式为__________;铜帽溶解完全后,可采用_____方法除去溶液中过量的H2O2。
(4)填充物中含有MnOOH、MnO2等化合物,向滤渣中加入一定量的稀草酸和l0mL稀硫酸,得到MnSO4溶液并收集到896mLCO2(标准状况下),所用稀硫酸的物质的量浓度是_________。
(5)向一定量水样中加入适量MnSO4溶液和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,运用此方法可以测定水中溶解氧的浓度。测定过程中物质的转化关系如下:
![]()
取一定量的池塘水样l00.00mL,按上述方法测定水样的溶解氧,消耗0.0100molL-1 Na2S2O3标准溶液13.50mL,该水样中的溶解氧的浓度为____mgL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f分别是H、C、N、Na、Si、Cu六种元素中的其中一种,已知:图1表示的是六种元素单质的熔点高低顺序,其中c、d均是热和电的良导体,f形成的某种单质硬度最大。
回答下列问题:
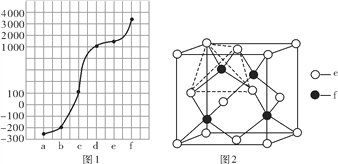
(1)a、b、f三种元素的电负性从小到大的顺序为________(用元素符号表示)。
(2)元素b的单质的一个分子中含有________个σ键和_________个π键。
(3)元素c的单质的晶体堆积方式类型是_______________________;若c单质分别与氟气和氯气形成化合物甲和乙,则甲的晶格能________乙的晶格能(填“>”“<”或“=”)。
(4)元素d的基态原子的价电子排布式为__________________。
(5)元素e和f可形成化合物丙(丙的晶胞结构如图2所示),则丙的化学式为_________;丙的晶体类型为_______________,在丙中,每个e原子周围最近的e原子数目为_____,若晶胞的边长为a pm,则丙的密度为____________g·cm-3(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com