
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 39gNa2O2与CO2完全反应,转移的电子数为![]()
B. 6.0gNO和3.2gO2混合,所得气体的分子数目为0.2![]()
C. 84gFe完全转化为Fe3O4,失去的电子数为4![]()
D. 1molCu和2mol热浓硫酸反应,生成SO2分子数目为![]()
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】有一反应:2A(g)+B(g)![]() 2C(g),下图中的曲线是该反应在不同温度下的平衡曲线,则下列描述正确的是
2C(g),下图中的曲线是该反应在不同温度下的平衡曲线,则下列描述正确的是

A. 该反应是放热反应
B. b点时混合气体的平均摩尔质量不再变化
C. T1时若由a点达到平衡,可以采取增大压强的方法
D. c点v正逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL 1 mol/L的稀HCl与锌粒反应,不会使反应速率加快的是( )
A. 升高温度
B. 将500 mL 1 mol/L的HCl改为1000 mL 1 mol/L的HCl
C. 用1 mol/L的H2SO4代替1 mol/L的HCl
D. 用锌粉代替锌粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5 L 1 mol·L-1FeCl3溶液与0.6 L 1 mol·L-1KCl溶液中,Cl-浓度比是
A. 9:2 B. 3:2 C. 3:1 D. 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示。下列有关说法不正确的是
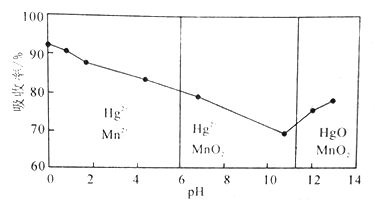
A. pH对Hg吸收率的影响规律是随pH升高Hg的吸收率先降低后升高
B. pH=l时Hg的吸收率高达90%的原因是KMnO4在酸性条件下氧化性强
C. pH = 2时反应的离子方程式为Hg+MnO4-+8H+=Hg2++Mn2++4H2O
D. pH = 12时反应的离子方程式为3Hg+2MnO4-+ H2O=3HgO+2MnO2+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当反应条件(如温度、浓度或物质的量等)发生改变时,下列不会引起生成物发生改变的是:
A. 钠和氧气 B. 碳酸钠和盐酸 C. 氢氧化钠和二氧化碳 D. 铁和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.4g Na2CO310H2O和NaHCO3组成的混合物溶于水配成100mL溶液,测得溶液中钠离浓度为0.6mol/L.若把等质量的混合物加热至恒重,残留物的质量是( )
A.3.18 g
B.2.12 g
C.4.22 g
D.5.28 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组运用下图所示组合装置(部分夹持装置未画出)进行探究实验
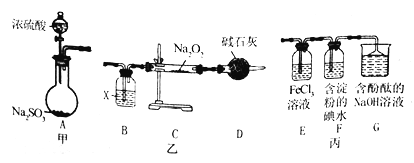
请回答下列问题:
(1)A同学将甲、乙装置组合进行进行实验,其实验目的是探究______反应的生成物;在连接好装置后,首先要进行的实验操作为____________。
(2)为检验C装置中反应生成物是否有氧气,装置B中盛放的试剂X应为______,装置D中碱石灰的作用是 _______;实验操作及现象是______。
(3)b同学将甲、丙装置组合进行实验,能说明I-的还原性弱于 SO2的现象为_____,发生反应的离子方程式是________。
(4)装置G中的现象是________,说明SO2具有____________性。
(5)为验证装置中SO2与FeCl3发生了氧化还原反应,C同学设计了两套方案,完成下表:
实验操作 | 实验现象 | 实验结论 | |
方案1 | 取少量装置E中的溶液于试管中,向其中滴加____溶液 | 产生白色沉淀 | SO2与FeCl3发生氧化还原反应 |
方案2 | 取少量装置E中的溶液于试管中,向其中滴加 ____溶液 | ____________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com