
【题目】某兴趣小组运用下图所示组合装置(部分夹持装置未画出)进行探究实验
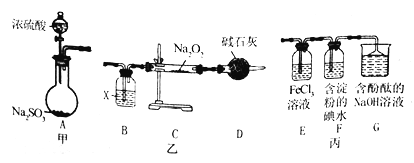
请回答下列问题:
(1)A同学将甲、乙装置组合进行进行实验,其实验目的是探究______反应的生成物;在连接好装置后,首先要进行的实验操作为____________。
(2)为检验C装置中反应生成物是否有氧气,装置B中盛放的试剂X应为______,装置D中碱石灰的作用是 _______;实验操作及现象是______。
(3)b同学将甲、丙装置组合进行实验,能说明I-的还原性弱于 SO2的现象为_____,发生反应的离子方程式是________。
(4)装置G中的现象是________,说明SO2具有____________性。
(5)为验证装置中SO2与FeCl3发生了氧化还原反应,C同学设计了两套方案,完成下表:
实验操作 | 实验现象 | 实验结论 | |
方案1 | 取少量装置E中的溶液于试管中,向其中滴加____溶液 | 产生白色沉淀 | SO2与FeCl3发生氧化还原反应 |
方案2 | 取少量装置E中的溶液于试管中,向其中滴加 ____溶液 | ____________ |
【答案】 SO2与Na2O2 检查装置的气密性 浓硫酸 吸收未反应的SO2,防止污染空气,同时防止空气中的水蒸气进入装置与Na2O2反应,干扰实验 将带火星的木条放在干燥管D出口处,若木条复燃,则有氧气生成,否则无氧气生成 装置F中溶液蓝色褪去 SO2+I2+2H2O=2I-+SO42-+4H+ 红色褪去 酸性 【答题空10】盐酸酸化的BaCl2 KSCN 溶液不变红
【解析】(1)A同学将甲、乙装置组合进行进行实验,甲装置利用亚硫酸钠与浓硫酸反应制取二氧化硫,气体干燥后进入乙装置与过氧化钠反应,故其实验目的是探究SO2与Na2O2反应的生成物;实验过程有气体的参与,在连接好装置后,首先要进行的实验操作为检查装置的气密性;(2)装置B中盛放浓硫酸,将通入的二氧化硫进行干燥,以免水蒸气进入装置乙中与过氧化钠反应生成氧气而引起干扰;装置D中碱石灰的作用是吸收未反应的SO2,防止污染空气,同时防止空气中的水蒸气进入装置与Na2O2反应,干扰实验;氧气的检验可将带火星的木条放在干燥管D出口处,若木条复燃,则有氧气生成,否则无氧气生成;(3)b同学将甲、丙装置组合进行实验, I-的还原性弱于 SO2,则碘单质被二氧化硫还原,现象为装置F中溶液蓝色褪去;发生反应的离子方程式是SO2+I2+2H2O=2I-+SO42-+4H+;(4)装置G中含有酚酞的氢氧化钠溶液呈红色,当过量的二氧化硫被吸收后溶液碱性减弱,现象是溶液红色褪去;说明SO2具有酸性;(5)方案1取少量装置E中的溶液于试管中,向其中滴加盐酸酸化的BaCl2,产生白色沉淀,证明溶液中含有硫酸根离子;方案2取少量装置E中的溶液于试管中,向其中滴加KSCN,溶液不变红,证明溶液中的铁离子已被还原为亚铁离子,从而证明二氧化硫与氯化铁发生了氧化还原反应生成了氯化亚铁、硫酸和盐酸。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将0.1 mol·L-1醋酸溶液加水稀释,下列说法正确的是( )
A. 溶液中c(OH-)和c(H+)都减小 B. 溶液中c(H+)增大
C. 醋酸电离平衡向左移动 D. 溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 39gNa2O2与CO2完全反应,转移的电子数为![]()
B. 6.0gNO和3.2gO2混合,所得气体的分子数目为0.2![]()
C. 84gFe完全转化为Fe3O4,失去的电子数为4![]()
D. 1molCu和2mol热浓硫酸反应,生成SO2分子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学物质及其变化的一种常用的科学方法。
(1)下列4组物质中均有一种物质的主要化学性质与其他3种不同。
A、CaO、Na2O、CO2、MgO B、CH3COOH、H2SO4、Ba(OH)2、HNO3
C、H2、Cl2、P、Cu D、HCl、CH3CH2OH、H2SO4、HNO3
①写出D组中不同于其他三种的物质的化学式:________。
②A组中的一种物质与B组中的—种物质反应的量不同产物有所不同。写出这两种物质反应有沉淀产生的离子反应方程式:_______。
③C组中Cu在一定条件下可与H2、Cl2、P等化合。写出 CuH在Cl2中燃烧的化学方程式:_________________。
(2)NaOH、Na2CO3、NaA1O2溶液都具有碱性。向500mL由NaOH、Na2CO3、NaA1O2组成的混合溶液中滴加0.2molL-1盐酸,所消耗盐酸体积如图所示,回答下列问题:
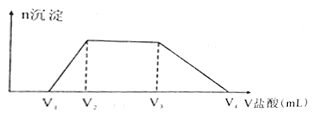
①写出加盐酸V1至 V2段反应的离子方程式:___________。
②用 36.5%(密度为1.19gmL-1) 的浓盐酸配制945mL0.2molL-1盐酸,需要量取的浓盐酸体积为_________________。
③若V1=50 mL,V2=100 mL,V3=200 mL,则V4= ______。原混合溶液中NaOH、Na2CO3、NaA1O2的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 等物质的量的NaN3和Na2O2中所含阴离子数均为NA
B. 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA
C. 标准状况下,将3.36LCl2通入1L0.2mol/LFeBr2溶液中,被氧化的Br-数目为0.1NA
D. 标准状况下,11g由3H和16O组成的超重水中,中子数和电子数之和为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝的叙述中,正确的是
A.铝在空气中能够稳定存在的原因是表面有氧化膜
B.钠能把铝从AlCl3溶液中置换出来
C.铝能溶解于冷浓硝酸中,生成硝酸铝
D.在化学反应中,铝容易失去电子,是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙醇、糖类和蛋白质都是人体必需的营养物质
B. 淀粉和纤维素都可以作为工业上生产葡萄糖的原料
C. 蔗糖、果糖的分子式均为C6H12O6,二者互为同分异构体
D. 纤维素和淀粉均属于糖类,它们在人体内水解的最终产物均为葡萄糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com