
【题目】下列说法正确的是
A.用100mL量筒量取1.3mL盐酸
B.配制氯化钠溶液时,用托盘天平称取8.55g氯化钠固体
C.容量瓶不能用作溶解物质的容器
D.粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3溶液加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
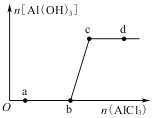
A. a点对应的溶液中:Na+、Fe3+、SO![]() 、HCO
、HCO![]()
B. b点对应的溶液中:Na+、S2-、SO![]() 、Cl-
、Cl-
C. c点对应的溶液中:Ag+、K+、NO![]() 、F-
、F-
D. d点对应的溶液中:K+、NH![]() 、I-、CO
、I-、CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻度(标线),这时应采取的措施是
A.倾出标线以上的液体 B.吸出标线以上的溶液
C. 影响不大,不再处理 D.重新配制.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年以来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式 .
②上述反应的平衡常数表达式K= , 根据上述信息判断,T1和T2的关系是 .
A.T1>T2 B.T1<T2 C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是 .
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2 , 具体流程如图1所示:
①用离子方程式表示反应器中发生的反应: .
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 .
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.
通过a气体的电极是原电池的极(填“正”或“负”),b电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治疗缺铁性贫血的常见方法是服用补铁药物,常采用更易被吸收的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水,但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中二价铁元素,设计并实施了如下实验:
![]()
试回答下列问题:
(1)试剂1是______________,试剂2是__________________。
(2)该同学预测加入试剂2后,溶液应依然为浅绿色,但这与实际现象不符,请用离子方程式解释实际现象的合理性:_________________,_______________。
(3)用离子反应方程式解释加入新制氯水后溶液变血红色的原因:______________________________________________。
(4)补铁药物的说明书中通常会有“与VC同服可增加本品吸收”的内容,向淡红色溶液中加入VC,片刻后溶液红色褪去,试从氧化还原角度解释补铁药物与VC同服的优点:___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究SO2的性质对改善空气质量具有重要意义。某化学兴趣小组为探究SO2的化学性质进行以下实验,如下图装置(加热及固定装置已略去)。

①以上实验中,体现SO2具有氧化性的实验现象为____________,对应化学方程式为_____________________。
② D装置的作用是__________,写出该装置中发生的离子方程式______________。
③ A中反应开始后,试管B中始终无明显现象。现将试管B中溶液分成两份,分别滴加一定量的氯水和氨水,均出现白色沉淀,任选其中一个实验,结合离子方程式进行解释:_____________________________________________。
(2)硫酸工厂的烟气中含有SO2,有多种方法可实现烟气脱硫。
① “钠碱法”用NaOH溶液作吸收剂,向 100 mL 0.3 mol·L-1的NaOH溶液中通入标准状况下0.448 L SO2气体,所得溶液中的溶质是_________________________________(填化学式)。
② 某硫酸厂拟用含Cr2O72的酸性废水处理烟气中SO2,反应后的铬元素以Cr3+形式存在,则反应中氧化剂和还原剂的物质的量之比是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,现有A、B、C、D、E、F六种常见化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+ , 阴离子有Cl﹣、OH﹣、CH3COO﹣、NO3﹣、SO42﹣、CO32﹣ , 现将它们分别配成0.1mol/L的溶液,进行如下实验:(已知:室温下,饱和氢氧化钙溶液浓度约为0.00165 g/mL)
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加Na2S溶液,出现难溶于强酸且阴阳离子个数比为1:2的黑色沉淀;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色.
根据上述实验现象,回答下列问题:
(1)写出下列化合物的化学式:A、B、C .
(2)实验④中白色沉淀变为红褐色对应的化学方程式:
(3)D与E的溶液反应离子方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有下图中物质的相互转化
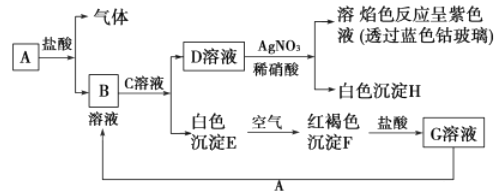
试回答:
(1)写出B的化学式________,D的化学式________。
(2)写出由E转变成F的化学方程式________。
(3)写出下列离子方程式:
D溶液与AgNO3溶液反应________;向G溶液中加入A________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com